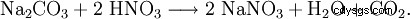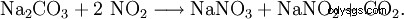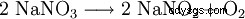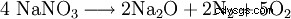| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Dobrze | |||||||
| Ogólne | |||||||
| Nazwa | Azotan sodu | ||||||
| Inne nazwy |
| ||||||
| Formuła molekularna | NaNO3 | ||||||
| Numer CAS | 7631-99-4 | ||||||
| Krótki opis | bezbarwne krystaliczne ciało stałe | ||||||
| Właściwości | |||||||
| Masa molowa | 84,99 g mol | ||||||
| Stan materii | naprawiono | ||||||
| Gęstość | 2,26 g/cm | ||||||
| Temperatura topnienia | 306.8 °C | ||||||
| Temperatura wrzenia | Rozkład od 380 °C | ||||||
| Ciśnienie pary | <0,001hPa (25°C) | ||||||
| Rozpuszczalność | łatwo rozpuszczalny w wodzie:874 g/l (przy 20 °C) | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| MAK | nie określono | ||||||
| LD50 | 1267 mg kg (szczur, doustnie) | ||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
Azotan sodu (także azotan Natron lub chilijska saletra ) jest związkiem chemicznym, solą sodową kwasu azotowego. W stanie czystym ma postać higroskopijnej (przyciągającej wodę) białej substancji lub bezbarwnych kryształów.
Zdarzenia
Azotan sodu jest najważniejszym naturalnie występującym azotanem. Głównym miejscem jest Chile, stąd potoczna nazwa saletra chilijska. Inne naturalne złoża znajdują się w Egipcie, Azji Mniejszej, Kolumbii i Kalifornii.
Ekstrakcja
Naturalne osady są oczyszczane z ciał obcych poprzez filtrację gorących solanek otrzymanych przez ługowanie gorącą wodą. Azotan sodu, który krystalizuje na zimno, ma czystość około 98%. Jod zawarty w roztworach macierzystych jest używany do ekstrakcji jodu.
Azotan sodu można również otrzymać w reakcji węglanu sodu z kwasem azotowym:
Idealna jest tutaj absorpcja gazów resztkowych z utleniania amoniaku w stężonym roztworze węglanu sodu:
W celu utlenienia azotynu zakwasza się go kwasem azotowym, utlenia na powietrzu do azotanu i neutralizuje węglanem sodu. Koncentruje się do postaci stałej w wyparkach próżniowych.
Właściwości
Właściwości fizyczne
- Ważne właściwości termodynamiczne
- Δf Hs :15,5 w kJ/mol
- Ss :116 w J/(mol K)
Właściwości chemiczne
W gorącym kwasie siarkowym przekształca się w wodorosiarczan sodu z wytworzeniem kwasu azotowego:
W temperaturze powyżej 380 °C rozkłada się do azotynu sodu:
W temperaturach powyżej 800 °C do tlenku sodu:
Wykorzystanie
- Nawóz
- Przemysł materiałów budowlanych:dodatek do cementu
- Produkcja chemiczna:azotan potasu
- Dawniej używany również do produkcji kwasu azotowego
- jako konserwant E 251
- do peklowania wyrobów mięsnych i wędliniarskich (również z azotynem sodu E 250 i azotynem potasu E 249)
- PCM do przechowywania termicznego
Dodatek do żywności
Azotan działa przeciwko bakteriom, szczególnie przeciwko budzącym postrach patogenowi zatrucia jadem kiełbasianym (Clostridium botulinum). Podczas procesu utwardzania mniej stabilny chemicznie pigment mięśni (mioglobina) jest przekształcany w bardziej stabilny wariant (zaczerwienienie). Dzięki temu mięso zachowuje swój czerwony kolor. Niepeklowane mięso i kiełbasy przybierają szary kolor, który większość konsumentów myli się z oznaką zepsucia. Ponadto podczas peklowania powstaje typowy aromat.
Azotan sodu stosuje się do kiełbas, twardych serów, półtwardych serów, marynowanych śledzi i szprotów.
Same azotany są nieszkodliwe. Ich stosowanie jest problematyczne, ponieważ przekształcają się w azotyny. Ta konwersja jest możliwa w żywności, ale także w ludzkim ciele.Azotyny mają działanie rozszerzające naczynia krwionośne i obniżające ciśnienie krwi. W większych dawkach mogą prowadzić do ostrych objawów zatrucia. (Brak hemoglobiny barwnika krwi =uzależnienie od niebieskiego). Azotyny mogą być przekształcane w organizmie człowieka w wysoce rakotwórcze nitrozoaminy przy jednoczesnej absorpcji białka.
Dowód
- Reakcje wykrywania
- Sód:jak jasnożółty w niebieskim płomieniu palnika Bunsena
- Azotan:Rozpuść końcówkę łopatki substancji w rozcieńczonym kwasie siarkowym i dodaj zimny, nasycony roztwór siarczanu żelaza(II). Podkład z odrobiną stężonego kwasu siarkowego. Na warstwie granicznej tworzy się brązowy pierścień, co jest dowodem na obecność azotanu (test pierścieniowy).
Źródła
- ↑ Baza danych substancji BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 czerwca 2007