| formula strutturale | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| K | |||||||||
| Generale | |||||||||
| Nome | Nitrito di potassio | ||||||||
| Altri nomi | Acido nitroso di potassio, E 249 | ||||||||
| Formula molecolare | KNO2 | ||||||||
| Numero CAS | 7758-09-0 | ||||||||
| Breve descrizione | solido giallo biancastro | ||||||||
| Proprietà | |||||||||
| Massa molare | 85,10 g mol | ||||||||
| Stato della materia | risolto | ||||||||
| Densità | 1,92 g cm | ||||||||
| Punto di fusione | 441°C | ||||||||
| Punto di ebollizione | Decomposizione | ||||||||
| Solubilità | buono in acqua (2810 g/L a 20 °C) | ||||||||
| Istruzioni di sicurezza | |||||||||
| |||||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||||
Nitrito di potassio , KNO2 (anche:nitrato di potassio , Inglese:nitrito di potassio ), è il sale di potassio dell'acido nitroso HNO2 .
Proprietà
Il nitrito di potassio forma cristalli da incolori a leggermente giallastri, altamente igroscopici (=attraggono l'umidità) che si dissolvono facilmente in acqua quando si raffredda, la soluzione reagisce in modo alcalino. I cristalli si decompongono a partire da 360 °C. Diversamente si comporta in modo simile al nitrito di sodio, cioè ossida (soprattutto a temperature più elevate) e reagisce violentemente con metalli come alluminio (soprattutto in polvere!), composti secchi di ammonio (come solfato di ammonio), cianuri e molti altri composti organici. È un agente riducente e si converte lentamente in nitrato di potassio KNO3 nell'aria ossidato.
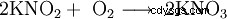
Il nitrito di potassio è tossico; in generale, i nitriti possono reagire con alcune ammine in condizioni idonee a formare nitrosammine cancerogene. I nitriti possono essere rilevati con solfato ferroso e acido solforico concentrato diventando marroni.
Evento e produzione
In natura i nitriti si presentano come stadi intermedi nel ciclo dell'azoto, sia nella nitrificazione (legame con l'azoto) che nella denitrificazione (rilascio di azoto).Tecnicamente, il nitrito di potassio si ottiene attraverso l'azione degli ossidi di azoto sulla soluzione di idrossido di potassio.
Utilizzo
Il nitrito di potassio può essere utilizzato come additivo alimentare con il numero E 249 (Conservanti) possono essere utilizzati in determinate condizioni nel sale per la cura dei nitriti (cloruro di sodio con nitrito di potassio e nitrito di sodio). Conferisce alla carne un colore rosso permanente attraverso la formazione di nitrosomioglobina. La carne e gli insaccati possono contenere un multiplo del limite di nitriti nell'acqua potabile.
Fonti
- ↑ Voce per CAS n. 7758-09-0 nel database delle sostanze GESTIS del BGIA, recuperato il 14 dicembre 2007 (JavaScript richiesto)



