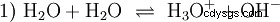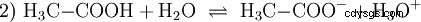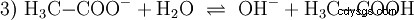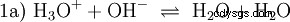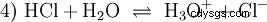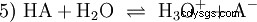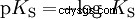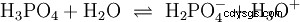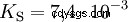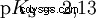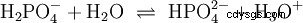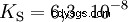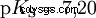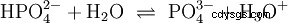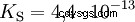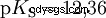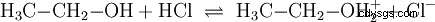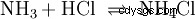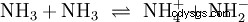acidi sono, in senso stretto, tutti i composti che sono in grado di trasferire protoni (H) a un partner di reazione - possono agire come donatori di protoni. In soluzione acquosa, il reagente è essenzialmente acqua. Ioni ossonio (H3 O), si abbassa così il pH della soluzione. Gli acidi reagiscono con le cosiddette basi per formare acqua e sali. Una base è quindi l'opposto di un acido ed è in grado di neutralizzarlo.
In un senso più ampio, diversi concetti acido-base descrivono insiemi molto più ampi di reazioni chimiche che possono andare ben oltre le reazioni sopra menzionate.
Evoluzione storica degli acidi
Probabilmente il più antico acido conosciuto (lat. acidum ) è aceto (lat. acetum ), una soluzione acquosa di circa il 5% del composto acido acetico. Gli acidi erano qualcosa di simile all'aceto (oxos o acido ). In alchimia, l'acido era considerato una sostanza primordiale . Le proprietà acide erano basate su un singolo acido urico , entrato in vigore in varie sostanze. Gli acidi fanno schiumare la calce oi carbonati, hanno un effetto caustico e un sapore bruciante. A parte l'aceto e altri succhi vegetali, fino alla fine del XIII secolo non si conoscevano acidi. La vasta conoscenza degli acidi è stata attribuita a Geber, vissuto nell'VIII secolo, ma si basa su scritti del molto più giovane, il cosiddetto pseudo-Geber [1]. Sviluppata la conoscenza di vari acidi inorganici, che sono tutti varietà dell'elemento acqua sono stati attribuiti. Dal 18° secolo sono stati indicati come acidi minerali.
- Una produzione di acido nitrico (HNO3 ) fu probabilmente utilizzato dagli pseudo-donatori dopo il XIII secolo come dissoluzione dell'acqua (aqua dissolutiva ) o acqua forte (aqua fortis ) descritto. Il vetriolo di rame è stato riscaldato a fuoco rosso con salnitro e allume. I gas nitrosi fuoriescono, che formano acido nitrico con l'acqua. Questo acido era anche chiamato acqua di separazione , poiché dissolve l'argento in una reazione chimica ma non l'oro. Nel 1648, J. R. Glauber descrisse la produzione di acido nitrico concentrato (fumante) (spiritus acidus nitri ) per reazione con acido solforico.
- L'Aqua regia, dal punto di vista odierno una miscela di acido nitrico e acido cloridrico, era probabilmente nota presto, poiché può essere ottenuta con relativa facilità facendo reagire l'acido nitrico con il noto sal ammoniaca. Aqua regia era la regina di tutti gli acidi , nemmeno l'oro, il re dei metalli , potrebbe resistere.
- Acido solforoso (H2 SO3 ) è certamente noto da molto tempo, poiché può essere ottenuto bruciando zolfo elementare. L'acido solforico era certamente presente anche in molti processi. Processi più dettagliati per la preparazione dell'acido solforico (H2 SO4 ) furono descritti più dettagliatamente per la prima volta da A. Libavius nel 1597:a) ricottura di solfato di ferro o rame con vetrioli (Oleum vitrioli , acido solforico fumante) e b) combustione dello zolfo e successiva ossidazione con conseguente soluzione diluita (Oleum sulphuris ) portato. Un'implementazione tecnica è riuscita nel XIX secolo con il processo della camera di piombo.
- L'acido cloridrico (HCl) come composto indipendente divenne noto solo alla fine del XVI secolo. A. Libavius ha descritto una sintesi accendendo una miscela di sale comune e argilla. B. Valentino ha descritto la conversione del vetriolo e del sale comune in aqua caustica , l'acqua corrosiva. Le intense indagini di J. R. Glauber nel XVII secolo portarono al fantasma di sale di Glauber (Spiritus salis Faithrianus ) del molto concentrato, cosiddetto fumo acido cloridrico o il gas acido cloridrico.
L'importante termine base come controparte fenomenologica degli acidi fu usato nel XVII secolo da alchimisti come G. E. Stahl, R. Boyle e GF Rouelle, perché le sostanze "basiche" hanno il non volatile Base per fissazione di acidi volatili formato e può neutralizzare l'effetto (corrosivo) degli acidi. A. L. Lavoisier, che assegnava determinate proprietà a determinati composti chimici, fece passi fondamentali nella chimica nel XVIII secolo. Pensava che gli acidi fossero sempre formati da ossidi non metallici e acqua e le basi da ossidi metallici e acqua. J. von Liebig, d'altra parte, vedeva gli acidi come composti di idrogeno che possono essere convertiti in sali dai metalli.
Nel 1887 S. Arrhenius definì gli acidi come sostanze che, disciolte in acqua, rilasciano protoni (H) e basi come sostanze che, disciolte in acqua, liberano ioni idrossido (OH). Quando gli acidi e le basi sono combinati, si neutralizzano a vicenda per formare acqua. Tuttavia, la teoria era ancora insufficiente, poiché non erano inclusi composti privi di ossigeno:l'ammoniaca neutralizza anche un acido. Nel 1923, J. N. Brønsted e T. Lowry descrissero indipendentemente quella che è ancora oggi la definizione più importante di acidi e basi. Costituiscono la base delle spiegazioni acide di seguito.
Proprietà degli acidi
- Gli acidi attaccano particolarmente i metalli di base e la calce. Ma in caso di contatto sono a rischio anche gli indumenti, la pelle e gli occhi (tutti i materiali organici in genere). Attenzione! Le ustioni chimiche possono sempre verificarsi. Indossa occhiali di sicurezza!
- Ci sono acidi forti e deboli. L'acido cloridrico è un acido forte. L'acido acetico è un acido meno forte e l'acido carbonico è un acido debole.
- Gli acidi possono essere diluiti con acqua, ma il loro effetto diventa notevolmente più debole a seconda della diluizione. La diluizione di acidi concentrati è una reazione esotermica. Viene generato molto calore e la soluzione acida può spruzzare in modo incontrollabile. Pertanto, quando si diluisce, vale la regola di aggiungere l'acido all'acqua, non il contrario:"Prima l'acqua, poi l'acido, altrimenti accadrà la cosa mostruosa. “
- È una falsità comune che gli acidi siano sempre liquidi. Rappresentanti ben noti di acidi che sono presenti puramente come solidi sono la vitamina C e l'acido citrico.
- Gli acidi fanno diventare rossa la cartina tornasole blu.
- Gli "avversari degli acidi" sono le basi (soluzione base =liscivia). Possono neutralizzare gli acidi. Le basi sono anche caustiche e attaccano molte altre sostanze che non reagiscono necessariamente con gli acidi.
- Gli acidi, quando disciolti in acqua, conducono elettricità. Qui avviene un'elettrolisi, in cui si forma idrogeno al catodo (il polo) e la sostanza neutralizzata dello ione residuo acido (anione acido) si forma all'anodo (il polo +), ad esempio cloro nel caso di acido cloridrico. La riduzione (accettazione di elettroni) si verifica al catodo e l'ossidazione (perdita di elettroni) si verifica all'anodo.
Cosa sono gli acidi?
Senza approfondire vari concetti acido-base un modo possibile e comune di vedere le cose dovrebbe essere descritto qui come un'introduzione. solitamente è strettamente correlato agli acidi e spesso senza menzione esplicita la presenza e alcune proprietà dell'acqua. L'acqua pura è soggetta a ciò che è noto come autoprotolisi. Gli ioni ossonio (H3) sono formati dall'acqua in quantità molto piccole e uguali O) e ioni idrossido (OH):
Questa equazione di reazione dell'acqua mostra la proprietà di un acido, ovvero la capacità di formare H3 O ioni nell'acqua. Allo stesso tempo, nell'acqua si formano ioni OH. Una delle qualità che può avere una base. Tuttavia, l'acqua non è né una base né un acido e il loro comportamento è chiamato neutro . Questo si riferisce al pH, che è la concentrazione di H3 indica ioni O nell'acqua. L'acqua pura ha un pH di 7, una concentrazione molto piccola. Come tutte le reazioni descritte in questa sezione, questa è una reazione di equilibrio:la formazione degli ioni e la loro combinazione per formare l'acqua avviene costantemente e con la stessa frequenza. Neutro non significa che non succeda nulla.
Gli acidi sono composti chimici che possono interagire con l'acqua in un certo modo. Hanno atomi di idrogeno che sono legati come ioni (ionogenici). Ecco come l'acido acetico puro (H3 C-COOH) con acqua e forma più H3 O ioni. Quando si verifica una tale reazione, un composto può essere chiamato acido. Oltre allo ione ossonio, si forma anche l'anione acetato H3 C-COO:
L'acido acetico è un acido carbossilico e un acido piuttosto debole rispetto agli acidi inorganici come l'acido cloridrico. In soluzione acquosa, gran parte delle molecole giacciono indissociate come H3 C-COOH prima. Anche qui si stabilisce rapidamente un equilibrio. Per questo motivo, l'equazione di reazione sopra (2) può essere letta da destra a sinistra con uguale giustificazione. Un anione acetato reagisce con uno ione ossonio per formare acqua e acido acetico. In questa direzione di lettura avviene una reazione di base invece:La conversione degli ioni idroxonio in molecole d'acqua. Se ad una soluzione di acido acetico viene aggiunta una quantità adeguata di anioni acetato, ad esempio sotto forma di acetato di sodio facilmente solubile, la proprietà acida dell'acido acetico può essere completamente compensata dalla proprietà basica dello ione acetato. La soluzione acquosa viene neutralizzata. Neutro non significa che non accada nulla nella soluzione. Solo la concentrazione di H3 Gli ioni O sono bassi come nell'acqua pura.
Inoltre, la reazione di base essere considerato, che si verifica quando l'acetato di sodio è in puro l'acqua è disciolta:
Gli ioni idrossido (OH) si formano qui. L'aggiunta di una quantità adeguata di soluzione acquosa di acido acetico a questa soluzione di acetato rende la soluzione neutra . Si trova tra H3 O e OH entrano nell'equilibrio (1) inizialmente presentato come una proprietà fondamentale dell'acqua e rappresentato come Equazione (1a) invertita.
| Un acido può essere inteso come un composto chimico che ha la capacità in soluzione acquosa H3 per formare ioni O o convertire ioni OH in molecole d'acqua. Una base, invece, ha la capacità di formare ioni OH o H3 in soluzione acquosa O a H2 O. |
Molte sostanze denominate acidi sono soluzioni acquose fin dall'inizio e non possono essere facilmente comprese come composti chimici che hanno atomi di idrogeno legati ionicamente. L'acido cloridrico è una soluzione acquosa del gas acido cloridrico (HCl) ed è considerato un acido forte. In questa soluzione - prima di qualsiasi uso pratico dell'acido - esiste già l'equilibrio (4), in cui l'equilibrio è quasi completamente sul lato destro.
Il cloruro di idrogeno ha esaurito da tempo il suo potenziale di essere un acido e H3 O ioni formati. Gli effetti chimici che si verificano dall'applicazione pratica dell'acido cloridrico sono dovuti alle reazioni di H3 attribuita agli ioni O. L'acido è l'H3 Oh ione. Il valore del pH è qui la misura dell'acidità (concentrazione), mentre nel caso di acidi più deboli, come l'acido acetico, la misura della forza acida, il valore pKa, è in primo piano. Gli acidi forti e deboli differiscono nella loro tendenza "simile" o "meno simile" H3 per formare ione O nell'acqua. La sezione Bilancio acido-base descrive queste tendenze in modo più dettagliato.
| L'effetto chimico nell'uso pratico di un acido è principalmente su H3 O ioni indietro. Si possono considerare gli ioni ossonio come l'acido più importante. |
Equilibrio acido-base
Durante la protolisi, un reagente (solitamente acqua) assorbe il protone emesso dall'acido. Questo va distinto dalle reazioni redox in cui avvengono i trasferimenti di elettroni.
La reazione di equilibrio generale di un acido HA in soluzione acquosa è:
Gli acidi differiscono nella loro tendenza a trasferire ioni H all'acqua. Questo è chiamato Forza acida K s denota e indica la costante di equilibrio (costante di acido) della reazione acida. La costante di acidità è spesso data sotto forma di pK s -value, che è definito come il logaritmo negativo della costante di acidità.
Acidi con la K maiuscola s -value (piccolo pK s -value) sono acidi forti. Se il pH di una soluzione contenente un acido è due unità al di sotto del pK s valore, solo un centesimo di H3 O ioni formati.
Acidi polibasici
Gli acidi che possono scindere diversi protoni sono chiamati acidi poliprotici . Acido solforico (H2 SO4 ) è un acido fosforico diprotico (anche diprotico) (H3). PO4 ) un acido triprotonico (anche triprotonico). Il tentativo di liberare i singoli protoni (protolisi) ha dimensioni variabili e può essere calcolato utilizzando la costante di acido (Ks ) descrivere. In generale, per le singole fasi della protolisi si applica quanto segue:Ks (I)> Ks (II)> Ks (III) (o pKs (I)
Per l'acido fosforico:
pKS -Valori di acidi importanti
Reazioni acido-base senza acqua
Analogamente alle reazioni acido-base che avvengono in soluzioni acquose e con la partecipazione dell'acqua, ci sono reazioni in altri mezzi. Nell'etanolo anidro avviene una reazione con acido cloridrico, in cui l'etanolo svolge il ruolo di base:
Nella fase gassosa, i gas ammoniaca e acido cloridrico reagiscono per formare il sale cloruro di ammonio.
Oltre all'acqua, anche altri solventi sufficientemente polari possono agire come reagenti nelle reazioni acido-base. Un buon esempio è l'autoprotolisi dell'ammoniaca liquida:
Esempi di acidi
Gli acidi importanti sono:
- Acido solforico:H2 SO4 (uso industriale, piogge acide)
- Acido cloridrico:HCl (uso industriale)
- Acido fosforico:H3 PO4 (Industria alimentare, compresa cola, materiale genetico)
- Acido carbonico:H2 CO3 (industria alimentare, tecnologia, atmosfera)
- Acido acetico:CH3 COOH (industria alimentare)
- Acido fluoridrico:HF (produzione di chip per computer)
- Acido nitrico:HNO3 (uso industriale)
I sali degli acidi polibasici possono anche fungere da acidi ("sali acidi"), ad esempio
- Bisolfati
- Idrogeno fosfati
Riferimenti
Sviluppo storico degli acidi:
- Claus Priesner, Karin Figala:Alchimia:Enciclopedia di una scienza ermetica. Beck, Monaco di Baviera 1998, ISBN 3406441068
- V. Karpenko, J.A. Norris:Il vetriolo nella storia della chimica. Chem. Listy, Vol. 96, 2002, pagine:997-1005 [2]
- Donatori in Britannica
- Elenco degli acidi
- basi
- Concetti a base di acido