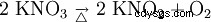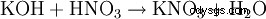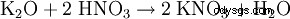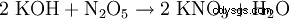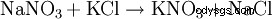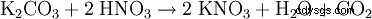| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| K | |||||||
| General | |||||||
| Nombre | Nitrato de potasio | ||||||
| Otros nombres |
| ||||||
| Fórmula molecular | KNO3 | ||||||
| Número CAS | 7757-79-1 | ||||||
| Breve descripción | polvo cristalino blanco | ||||||
| Propiedades | |||||||
| Masa molar | 101,11 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 2,109 g·cm (16 °C) | ||||||
| Punto de fusión | 334 °C | ||||||
| Punto de ebullición | Descomposición>400 °C | ||||||
| Solubilidad | bueno en agua (316 g/L a 20 °C), pobre en disolventes no polares | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Nitrato de potasio , más conocido como Saltpeter en el lenguaje común , concretamente como nitrato de potasio , es la sal de potasio del ácido nítrico.
Propiedades
El nitrato de potasio forma cristales incoloros, que se disuelven en agua con un fuerte enfriamiento. Por lo tanto, es mucho más fácilmente soluble en agua tibia que en agua fría. Se pueden disolver hasta 130g de nitrato de potasio en 1 litro de agua a 0°C, y hasta 2455g de nitrato de potasio en 1 litro de agua a 100°C. A concentraciones tan altas, la densidad de la solución es significativamente mayor que la del agua pura.
El nitrato de potasio se descompone en nitrito de potasio y oxígeno al calentarlo:
Es un excelente agente oxidante a temperaturas elevadas. Los residuos carbonizados en la cristalería se disuelven rápidamente en nitrato de potasio fundido.
El nitrato de potasio es significativamente menos higroscópico que muchos otros nitratos, p. B. Nitrato de sodio.
Extracción
- Ocurrencias naturales
El nitrato de potasio (min. "Nitrokalit") se presenta como eflorescencia en los suelos. De importancia económica fueron los yacimientos de China y el sudeste asiático, donde en la primera mitad del siglo XIX se extraían anualmente más de 10.000 toneladas de salitre por lixiviación de dichos suelos.
- Nitrificación bacteriana de residuos orgánicos ricos en nitrógeno Desde finales del siglo XIV hasta el XIX, el salitre se producía en Europa con la ayuda de bacterias y oxígeno atmosférico para ser independientes de la importación de esta materia prima, indispensable para la guerra. (ver "Historia"). Los residuos orgánicos ricos en nitrógeno (estiércol y orina) se mezclan con cal y cenizas de madera (potasa) y se dejan descomponer en montones de tierra sueltos y permeables al aire. Los compuestos de nitrógeno son convertidos en nitratos por bacterias. Después de dos años, la masa se lixivia con agua. La potasa se agrega a la lejía cruda, convirtiendo así el nitrato de calcio y magnesio en nitrato de potasio y el carbonato alcalinotérreo poco soluble. El nitrato de potasio se obtiene evaporando la lejía filtrada, que luego se purifica por recristalización.
- Conversión salitre
Desde mediados del siglo XIX hasta alrededor de 1920, la conversión del nitrato chileno con cloruro de potasio fue el proceso más importante para la producción de nitrato de potasio:NaNO3 + KCl --> KNO3 + NaCl
Aquí se utiliza el ligero aumento de la solubilidad del cloruro de sodio con la temperatura:las aguas madres de KNO3 -La cristalización en el ciclo anterior se calienta y se adiciona con nitrato de sodio crudo y cloruro de potasio en proporción estequiométrica. La mezcla se concentra con la adición de un poco de sosa a 100 ◦ C, durante lo cual precipitan cloruro de sodio y las impurezas (carbonatos de metales alcalinotérreos) y se separan por filtración. El filtrado se diluye de nuevo con el condensado de la evaporación para evitar la precipitación de sales de sodio durante el enfriamiento, se filtra y luego se enfría a 5ºC para cristalizar el nitrato de potasio y se centrifuga. El nitrato de potasio separado se recristaliza con fines técnicos.
- Sintético a partir de ácido nítrico
Hoy en día, el nitrato de potasio se produce sintéticamente (ver Representación ).
Apariencia (Fabricación)
Hay muchas formas de representar el nitrato de potasio:
- por casi todas las reacciones de formación de sales:
- de carbonato de potasio:
Uso
- El nitrato de potasio se utiliza para conservar los alimentos (sal de curado E 252)
- Utilizado para producir pólvora negra y otras mezclas pirotécnicas
- Una mezcla de 24 % de boro + 71 % de KNO3 + 5 % de aglutinante (PMMA) sirve como una mezcla de ignición fiable que también arde a temperaturas muy bajas (-196 °C).
- Una mezcla de 60 % de NaNO3 +40 % KNO3 funde a 222°C y se utiliza como medio de transferencia de calor en plantas de energía solar térmica. Esta sal fundida es químicamente estable hasta 590 °C, tiene una alta capacidad calorífica específica de 1,55 kJ/(kg K), una densidad de 1,79 g/cm³ y es tan fina como el agua (viscosidad:2,1 mPa·s). Humedece las superficies metálicas con mucha facilidad, lo que puede provocar problemas de sellado si la construcción y la selección del material no son adecuadas. Los aceros inoxidables son en gran medida resistentes a las fusiones de nitrato (índice de erosión:6 - 15 µm/año a 570 °C). El coeficiente de transferencia de calor en la tubería de flujo turbulento es de aproximadamente 6000 W/K m². Debido a su alta capacidad calorífica (2,8 MJ/(K m³)), el salitre fundido también es adecuado como medio de almacenamiento de calor. La temperatura de fusión se puede reducir aún más agregando nitrito de sodio. Una mezcla de sal de 53% KNO3 llamada HiTec + 40% NaNO2 + 7% NaNO3 funde a 140°C y tiene propiedades particularmente favorables como medio de transferencia de calor si la toxicidad del nitrito de sodio es irrelevante.
- Los baños de salitre se utilizan para el tratamiento térmico de aleaciones de aluminio forjado con un contenido de magnesio de hasta el 10%. La temperatura máxima permisible de la sal fundida depende del contenido de magnesio; cae de 550°C a 0,5% Mg a 380°C a 10% Mg.
- en granadas de humo
- en fertilizante
Historia
Ya en el siglo XI se menciona el salitre en el libro de Marcus Graecus, que también menciona por primera vez la mezcla de polvo negro, como una nueva sustancia que se raspa de la tierra y las piedras. El libro de finales del siglo XIII sobre el combate montado y el uso de máquinas de guerra de Hassan ar-Rammah (Al-Furusiyya wa al-Manasib al-Harbiyya ) ya contiene varias normas para la limpieza del salitre con ceniza de madera y para la preparación de artefactos incendiarios y combustible para cohetes.
El salitre se importó inicialmente de la India; Venecia obtuvo grandes ganancias del comercio intermedio. Con una demanda creciente y por motivos de independencia, desde finales del siglo XIV los gobiernos promovieron la producción propia de salitre y aseguraron todos los derechos de producción, importación y uso mediante leyes draconianas a través de un "régimen salitrero". Debido a la rápida liberación de oxígeno, el salitre fue la base de la repentina combustión de azufre y carbón vegetal en pólvora y por tanto, como sustancia crónicamente escasa, la materia prima estratégica durante seis siglos.
En Turingia había nueve fábricas de salitre en el siglo XVI. Las orillas del Vltava, cerca de Praga, se cubrieron con "bancos sanitarios", y la ciudad de Halle otorgó una concesión para extraer salitre de los basureros. La creciente demanda de salitre se cubrió en parte con más importaciones, principalmente de India, y con plantas propias.
Desde finales del siglo XIV se cultivaron sistemáticamente huertas salitreras. Los desechos animales (estiércol, heces, orina y sangre) se rellenaban con tierra calcárea, tierra de cementerios o mataderos o de ciénagas y con cal, escombros y cenizas en fosos o se amontonaban y ocasionalmente se vertían con estiércol líquido u orina. Después de uno o dos años, la descomposición produjo tanto salitre que pudo ser lavado de la tierra. El rendimiento fue de aproximadamente 6:1, es decir, de 6 kg de tierra salitrera se obtuvo 1 kg de salitre.
A los caldereros salitreros como profesión especial y muy impopular se les permitía entrar en las propiedades en cualquier momento y buscar allí salitre. Esto fue cierto incluso para las iglesias en los siglos 17 y 18, excluyendo los tiempos de adoración. En Suecia, los agricultores incluso tenían que pagar parte de sus impuestos en salitre.
En el siglo XIX, hubo incluso una guerra salitrera, que Chile libró contra sus países vecinos para obtener la posesión exclusiva de los enormes depósitos desérticos de nitrato de sodio ("Caliche"), que ahora se podía convertir inmediatamente con sales de potasio para formar nitrato de potasa Este proceso de conversión finalmente fue reemplazado a partir de 1916 por el proceso Haber-Bosch de generar amoníaco a partir del aire y el agua con la posterior conversión en ácido nítrico.
Fuentes
- ↑ Entrada sobre nitrato de potasio en la base de datos de sustancias GESTIS de la BGIA, recuperada el 3 de septiembre de 2007 (se requiere JavaScript)
Referencias
- Perry, R.H., Chemical Engineers' Handbook, 4.ª ed., McGraw-Hill Book Company, Nueva York, 1963, págs. 9-77
- Janz, GH, et al., Compilaciones de datos de propiedades físicas relevantes para el almacenamiento de energía II. Sales fundidas, NSRDS, abril de 1979
- Gartz, J, historia cultural de los explosivos, E.S.Mittler &Son, Hamburgo, 2006