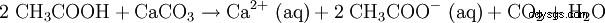| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| General | |||||||
| Nombre | Ácido acético | ||||||
| Otros nombres |
| ||||||
| Fórmula molecular | C2 H4 O2 | ||||||
| Número CAS | 64-19-7 | ||||||
| Breve descripción | líquido incoloro de olor acre | ||||||
| Propiedades | |||||||
| Masa molar | 60,05 g mol | ||||||
| Estado de la materia | líquido | ||||||
| Densidad | 1,05 g·cm | ||||||
| Punto de fusión | 17 °C | ||||||
| Punto de ebullición | 118 °C | ||||||
| Presión de vapor | 16hPa (20°C) | ||||||
| valor pKa | 4.75 | ||||||
| Solubilidad | completamente miscible con agua (20 °C) | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | no especificado | ||||||
| Propiedades termodinámicas | |||||||
| ΔHf | −483,52 kJ mol | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Ácido acético , según la normativa IUPAC ácido etanoico , es un ácido carboxílico cáustico, líquido e incoloro con un olor típico a vinagre. Como aditivo alimentario, tiene la designación E260. Las soluciones acuosas de ácido acético se llaman trivialmente vinagre y ácido acético concentrado ácido acético glacial. El nombre latino del ácido acético es Acidum aceticum . Las sales del ácido acético se denominan acetatos designado. En bioquímica, se prefiere el término acetato al de ácido acético, ya que el ácido acético se desprotona en gran medida en condiciones fisiológicas como el anión acetato (CH3 director de operaciones) está presente.
Obtención y visualización
Producción ecológica clásica
La producción clásica de ácido acético es la fermentación. Las bacterias Acetobacter convierten el etanol (alcohol) producido por otros procesos de fermentación en ácido acético (vinagre de fermentación). Los productos iniciales pueden, p. p.ej. vino, cerveza o malta.Vinagre casero consiste en vinagre de fermentación o vinagre sintético diluido y contiene 5% de ácido acético. Esencia de vinagre es una solución de ácido acético sintético al 25 % en agua, tiene un fuerte olor acre y solo puede usarse diluido en alimentos.
Fabricación de productos químicos a gran escala
La síntesis industrial más importante del ácido acético es la conversión catalítica de metanol con monóxido de carbono bajo presión (proceso Monsanto).
CH3OH + CO → CH3COOH
Aparte de esto, el ácido acético también se puede sintetizar por oxidación de acetaldehído con aire u oxígeno usando Mn(OAc)2 como catalizador o por oxidación parcial de otros hidrocarburos.
Técnicamente, también se utilizan la oxidación del aire del n-butano a unos 180 °C y 85 bar y la oxidación catalítica de la gasolina ligera.
Propiedades
Propiedades Físicas
Cuando el ácido acético se disuelve en agua, aproximadamente una de cada cien moléculas de ácido acético se disocia para formar un ion acetato. El protón separado se transfiere a una molécula de agua. Los iones de oxonio formados en este proceso provocan las propiedades ácidas de las soluciones de ácido acético.
A 118 °C, el ácido acético tiene un punto de ebullición relativamente alto en comparación con las sustancias polares con una masa molar comparable (p. ej., 1-propanol:punto de ebullición 97 °C). La razón de esto es la capacidad de las moléculas de ácido acético para formar dos enlaces de hidrógeno "mutuos" a través de sus grupos carboxilo, de modo que se forman dímeros a partir de dos moléculas de ácido acético, que se comportan como una molécula con el doble de masa molar. Por lo tanto, se requiere una mayor cantidad de energía para la transferencia de estos dímeros a la fase gaseosa, reconocible por la temperatura de ebullición "aumentada".
Propiedades químicas
El ácido acético se oxida completamente en el aire para formar agua y dióxido de carbono.
Los metales básicos como magnesio, calcio, zinc o hierro se disuelven en ácido acético diluido para formar acetatos solubles en agua y liberar hidrógeno.
El ácido acético reacciona con el cobre en presencia de oxígeno (aire) para formar acetato de cobre, una sal verde y nociva mejor conocida como cardenillo.
El ácido acético reacciona con el etanol para formar acetato de etilo, un solvente ampliamente utilizado. Sustituyendo el etanol por 1-pentanol se obtiene acetato de amilo, que es un éster de olor fuerte. El ácido salicílico también se puede esterificar con ácido acético. Esto produce ácido acetilsalicílico, el ingrediente activo de la aspirina.
El ácido acético reacciona a 800 °C con deshidratación a anhídrido acético.
El ácido acético diluido también se usa para disolver la cal (ver vinagre). La ecuación de reacción se ve así:
Propiedades termodinámicas
La entropía estándar del líquido en un bar (Sl, 1 bar ) es 158.0 J mol K, la del sólido (Ss ) 282,84 J mol K.
Uso
El ácido acético es de gran importancia como agente aromatizante. El ácido acético y sus sales acetato de potasio (E 261), acetato de sodio (E 262) y acetato de calcio (E 263) se utilizan como acidulantes para frutas y verduras en latas y tarros (0,5-3% de ácido acético), para todo tipo de pescado, conservas, adobos varios, ensaladas delicatessen, mayonesa, aderezos para ensaladas junto con ácido sórbico (E 200) o ácido benzoico (E 210) y para encurtir y lavar carne fresca.
El efecto bactericida del ácido acético es que el valor de pH modificado previene los procesos fisiológicos y también desnaturaliza las proteínas.
El ácido acético también se utiliza en la producción de cosméticos (cremas, jabones).
Sales de ácido acético (acetatos)
Las sales o ésteres del ácido acético se denominan acetatos designado. En su mayoría son sales cristalinas incoloras que contienen el anión acetato (CH3 director de operaciones).
Ejemplos de acetatos similares a la sal son el acetato de sodio (NaCH3 COO), acetato de potasio (KCH3 COO) o acetato de plomo(II) (Pb(CH3 director de operaciones)2 ).
Los acetatos salinos se obtienen neutralizando el ácido acético con hidróxidos metálicos u óxidos metálicos:
-
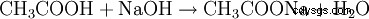
- El ácido acético y el hidróxido de sodio reaccionan para formar acetato de sodio y agua.
-
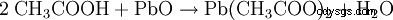
- El ácido acético y el óxido de plomo(II) producen acetato de plomo y agua.
En el análisis químico, los acetatos se pueden detectar fácilmente al moler la muestra con hidrógeno sulfato de potasio en un mortero. En este proceso, el protón (H) del ion sulfato de hidrógeno se transfiere al ion acetato, produciendo ácido acético volátil, que puede identificarse fácilmente por su olor característico:
-

- El acetato se protona con sulfato de hidrógeno. Se forman ácido acético y sulfato.
Los ésteres de ácido acético contienen el radical acetilo como radical ácido. El más conocido de estos ésteres es el acetato de etilo. Los acetatos orgánicos se obtienen esterificando ácido acético con alcoholes (R-OH):
-

- El ácido acético y el alcohol reaccionan para formar un éster de ácido acético y agua.
Fuentes
- ↑ Base de datos de sustancias de BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 de agosto de 2007