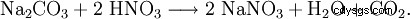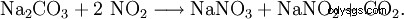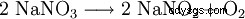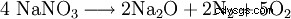| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| Bueno | |||||||
| General | |||||||
| Nombre | Nitrato de sodio | ||||||
| Otros nombres |
| ||||||
| Fórmula molecular | NaNO3 | ||||||
| Número CAS | 7631-99-4 | ||||||
| Breve descripción | sólido cristalino incoloro | ||||||
| Propiedades | |||||||
| Masa molar | 84,99 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 2,26 g·cm | ||||||
| Punto de fusión | 306,8 °C | ||||||
| Punto de ebullición | Descomposición a partir de 380 °C | ||||||
| Presión de vapor | <0,001 hPa (25 °C) | ||||||
| Solubilidad | fácilmente soluble en agua:874 g/l (a 20 °C) | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | no especificado | ||||||
| LD50 | 1267 mg kg (rata, oral) | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Nitrato de sodio (también nitrato de natrón o salitre chileno ) es un compuesto químico, la sal de sodio del ácido nítrico. En estado puro, se encuentra en forma de una sustancia blanca higroscópica (que atrae el agua) o de cristales incoloros.
Ocurrencias
El nitrato de sodio es el nitrato natural más importante. La localidad principal es Chile, de ahí el nombre común Chile salitre. Hay otros depósitos naturales en Egipto, Asia Menor, Colombia y California.
Extracción
Los depósitos naturales se limpian de materias extrañas mediante la filtración de salmueras calientes obtenidas por lixiviación con agua caliente. El nitrato de sodio que cristaliza en frío tiene una pureza de alrededor del 98%. El yodato contenido en las aguas madres se utiliza para la extracción de yodo.
El nitrato de sodio también se puede obtener haciendo reaccionar carbonato de sodio con ácido nítrico:
La absorción de gases residuales de la oxidación de amoníaco en una solución concentrada de carbonato de sodio es ideal aquí:
Para oxidar el nitrito, se acidifica con ácido nítrico, se oxida a nitrato en el aire y se neutraliza con carbonato de sodio. Se concentra hasta obtener un sólido en evaporadores al vacío.
Propiedades
Propiedades físicas
- Propiedades termodinámicas importantes
- Δf Hs :15,5 en kJ/mol
- Ss :116 en J/(mol·K)
Propiedades químicas
En ácido sulfúrico caliente, se convierte en hidrogenosulfato de sodio con la formación de ácido nítrico:
A temperaturas superiores a 380 °C se descompone en nitrito de sodio:
A temperaturas superiores a 800 °C al óxido de sodio:
Uso
- Fertilizante
- Industria de materiales de construcción:aditivo de cemento
- Fabricación de productos químicos:nitrato de potasio
- Anteriormente también se usaba para producir ácido nítrico
- como conservante E 251
- para curar productos cárnicos y embutidos (también con nitrito de sodio E 250 y nitrito de potasio E 249)
- PCM para almacenamiento térmico
Aditivo alimentario
El nitrato actúa contra las bacterias, especialmente contra el temido patógeno del botulismo (Clostridium botulinum). Durante el proceso de curado, el pigmento muscular químicamente menos estable (mioglobina) se convierte en una variante más estable (enrojecimiento). Como resultado, la carne conserva su color rojo. Las carnes y embutidos no curados adquieren un color gris que la mayoría de los consumidores confunden con una indicación de deterioro. Además, se forma un aroma típico durante el curado.
El nitrato de sodio se utiliza para embutidos, quesos duros, quesos semiduros, arenques en escabeche y espadines.
Los nitratos en sí mismos son inofensivos. Su uso es problemático porque se convierten en nitritos. Esta conversión es posible en los alimentos, pero también en el cuerpo humano.Los nitritos tienen un efecto vasodilatador y reductor de la presión arterial. En dosis más altas, pueden provocar síntomas agudos de intoxicación. (Falta del pigmento sanguíneo hemoglobina =adicción azul). El nitrito se puede convertir en nitrosaminas altamente cancerígenas en el cuerpo humano con la absorción simultánea de proteínas.
Prueba
- Reacciones de detección
- Sodio:como amarillo brillante en la llama azul del mechero Bunsen
- Nitrato:Disuelva la punta de la espátula de la sustancia en ácido sulfúrico diluido y agregue una solución saturada fría de sulfato de hierro (II). Subcapa con un poco de ácido sulfúrico concentrado. Se forma un anillo marrón en la capa límite, que es prueba de nitrato (ring test).
Fuentes
- ↑ Base de datos de sustancias de BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 de junio de 2007