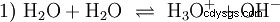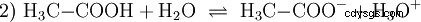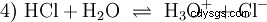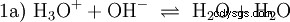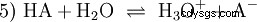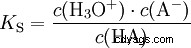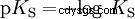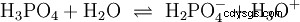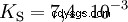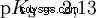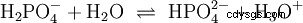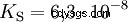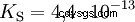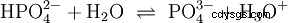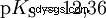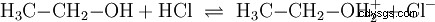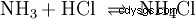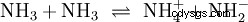syror är i snävare mening alla föreningar som kan överföra protoner (H) till en reaktionspartner - de kan fungera som en protondonator. I vattenlösning är reaktanten väsentligen vatten. Oxoniumjoner (H3 Sålunda sänks lösningens pH-värde. Syror reagerar med så kallade baser och bildar vatten och salter. En bas är därför motsatsen till en syra och kan neutralisera den.
I en vidare mening beskriver olika syra-basbegrepp mycket bredare uppsättningar av kemiska reaktioner som kan gå långt utöver de reaktioner som nämns ovan.
Historisk utveckling av syror
Förmodligen den äldsta kända syran (lat. acidum ) är vinäger (lat. acetum ), en cirka 5 % vattenlösning av föreningen ättiksyra. Syror var något vinägerliknande (oxos eller acidus ). Inom alkemin ansågs syra vara en ursubstans . De sura egenskaperna baserades på en enda urinsyra , som trädde i kraft i olika ämnen. Syror får kalk eller karbonater att skumma, har en frätande effekt och en brännande smak. Förutom vinäger och andra växtsafter var inga syror kända förrän i slutet av 1200-talet. Utökad kunskap om syror tillskrevs Geber, som levde på 800-talet, men den bygger på skrifter av den mycket yngre, så kallade pseudo-Geber [1]. Kunskap om olika oorganiska syror utvecklats, som alla är varianter av grundämnet vatten tillskrevs. Från 1700-talet kallades de mineralsyror.
- En produktion av salpetersyra (HNO3 ) användes troligen av pseudogivarna efter 1200-talet som upplösande vatten (aqua dissolutiva ) eller starkt vatten (aqua fortis ) beskrivs. Kopparvitriol värmdes till röd värme med salpeter och alun. Nitrösa gaser kommer ut som bildar salpetersyra med vatten. Denna syra kallades också separationsvatten , eftersom det löser silver i en kemisk reaktion men inte guld. År 1648 beskrev J. R. Glauber produktionen av koncentrerad (rykande) salpetersyra (spiritus acidus nitri ) genom reaktion med svavelsyra.
- Regiavatten, ur dagens synvinkel en blandning av salpeter- och saltsyra, var troligen tidigt känd, eftersom den relativt lätt kan erhållas genom att reagera salpetersyra med den välkända salammoniaken. Regiavatten var drottningen av alla syror , inte ens guld, metallernas kung , kunde motstå.
- Svavelsyra (H2 SO3 ) har säkert varit känt sedan länge, eftersom det kan erhållas genom förbränning av elementärt svavel. Svavelsyra fanns säkert också i många processer. Mer detaljerade processer för framställning av svavelsyra (H2 SO4 ) beskrevs först mer i detalj av A. Libavius 1597:a) glödgning av järn eller kopparsulfat med vitrioler (Oleum vitrioli , rykande svavelsyra) och b) förbränning av svavel och efterföljande oxidation som resulterar i utspädda lösningar (Oleum sulphuris ) led. En teknisk implementering lyckades på 1800-talet med ledningskammarprocessen.
- Saltsyra (HCl) som en oberoende förening blev känd först i slutet av 1500-talet. A. Libavius beskrev en syntes genom att antända en blandning av vanligt salt och lera. B. Valentinus beskrev omvandlingen av vitriol och koksalt till aqua caustica , det frätande vattnet. Intensiva undersökningar av J. R. Glauber på 1600-talet ledde till Glaubers saltspöke (Spiritus salis Faithrianus ) av den mycket koncentrerade, så kallade rökning saltsyra eller gasen klorväte.
Den viktiga termen bas som en fenomenologisk motsvarighet till syror användes på 1600-talet av alkemister som G. E. Stahl, R. Boyle och GF Rouelle, eftersom "bas" ämnen har de icke-flyktiga Grund för fixering av flyktiga syror bildas och kan neutralisera den (frätande) effekten av syror. A. L. Lavoisier, som tilldelade vissa kemiska föreningar vissa egenskaper, gjorde grundläggande steg i kemin på 1700-talet. Han trodde att syror alltid bildades av icke-metalloxider och vatten, och baser från metalloxider och vatten. J. von Liebig såg däremot syror som väteföreningar som kan omvandlas till salter av metaller.
År 1887 definierade S. Arrhenius syror som ämnen som vid upplösning i vatten frigör protoner (H) och baser som ämnen som vid upplösning i vatten frigör hydroxidjoner (OH). När syror och baser kombineras neutraliserar de varandra och bildar vatten. Teorin var dock fortfarande otillräcklig, eftersom föreningar utan syre inte ingick:ammoniak neutraliserar också en syra. År 1923 beskrev J. N. Brønsted och T. Lowry oberoende vad som fortfarande är den viktigaste definitionen av syror och baser idag. De utgör grunden för sura förklaringar nedan.
Syrors egenskaper
- Syror angriper särskilt basmetaller och kalk. Men även kläder, hud och ögon (alla organiskt material i allmänhet) är i riskzonen vid kontakt. Varning! Kemiska brännskador kan alltid hända. Använd skyddsglasögon!
- Det finns starka och svaga syror. Saltsyra är en stark syra. Ättiksyra är en mindre stark syra och kolsyra är en svag syra.
- Syror kan spädas ut med vatten, men deras effekt blir betydligt svagare beroende på utspädningen. Spädning av koncentrerade syror är en exoterm reaktion. Mycket värme genereras och syralösningen kan sprayas okontrollerat. Därför gäller vid utspädning regeln att tillsätta syran i vattnet, inte tvärtom:"Först vattnet, sedan syran, annars händer det monstruösa. "
- Det är en vanlig osanning att syror alltid är flytande. Välkända representanter för syror som är närvarande rent som fasta ämnen är vitamin C och citronsyra.
- Syror blir blått lackmuspapper rött.
- "Syrornas motståndare" är baserna (baslösning =lut). De kan neutralisera syror. Baser är också frätande och angriper många andra ämnen som inte nödvändigtvis reagerar med syror.
- Syror leder elektricitet när de löses i vatten. Här sker en elektrolys, där väte bildas vid katoden (-polen) och den neutraliserade substansen av syrarestjonen (syraanjon) bildas vid anoden (+polen), t ex klor i fallet med saltsyra. Reduktion (acceptans av elektroner) sker vid katoden och oxidation (förlust av elektroner) sker vid anoden.
Vad är syror?
Utan att utveckla olika syra-baskoncept ett möjligt och vanligt sätt att se på saker och ting ska här beskrivas som en introduktion. vanligtvis är nära besläktad med syror och ofta utan uttryckligen omnämnande vattnets förekomst och vissa egenskaper. Rent vatten är föremål för vad som kallas autoprotolys. Oxoniumjoner (H3) bildas av vattnet i mycket små och lika stora mängder O) och hydroxidjoner (OH):
Denna reaktionsekvation för vatten visar egenskapen hos en syra, nämligen förmågan att bilda H3 O-joner i vatten. Samtidigt bildas OH-joner i vatten. En av de egenskaper en bas kan ha. Men vatten kallas varken bas eller syra och deras beteende kallas neutralt . Detta avser pH, vilket är koncentrationen av H3 indikerar O-joner i vatten. Rent vatten har ett pH på 7, en mycket liten koncentration. Liksom alla reaktioner som beskrivs i detta avsnitt är denna reaktion en jämviktsreaktion:bildandet av jonerna och deras kombination för att bilda vatten sker konstant och med samma frekvens. Neutral betyder inte att ingenting händer.
Syror är kemiska föreningar som kan interagera med vatten på ett visst sätt. De har väteatomer som är bundna som joner (jonogena). Så här ren ättiksyra (H3 C-COOH) med vatten och bildar mer H3 O joner. När en sådan reaktion inträffar kan en förening kallas en syra. Förutom oxoniumjonen bildas även acetatanjonen H3 C-COO:
Ättiksyra är en karboxylsyra och en ganska svag syra jämfört med oorganiska syror som saltsyra. I vattenlösning ligger en stor del av molekylerna odissocierade som H3 C-COOH innan. Även här etableras snabbt en jämvikt. Av denna anledning kan ovanstående reaktionsekvation (2) läsas från höger till vänster med samma motivering. En acetatanjon reagerar med en oxoniumjon för att bilda vatten och ättiksyra. I denna läsriktning sker en grundläggande reaktion istället:Omvandlingen av hydroxoniumjoner till vattenmolekyler. Om en lämplig mängd acetatanjoner, t.ex. i form av det lättlösliga natriumacetatet, tillsätts till en ättiksyralösning, kan ättiksyrans sura egenskap helt kompenseras av acetatjonens basiska egenskap. Den vattenhaltiga lösningen neutraliseras. Neutral betyder inte att ingenting händer i lösningen. Endast koncentrationen av H3 O-joner är lika låga som i rent vatten.
Dessutom den grundläggande reaktionen övervägas, vilket inträffar när natriumacetat är rent vatten löses upp:
Här bildas hydroxidjoner (OH). Att tillsätta en lämplig mängd vattenhaltig ättiksyralösning till denna acetatlösning gör lösningen neutral . Den står mellan H3 O och OH går in i jämvikten (1) som initialt presenterades som en grundläggande egenskap hos vatten och representeras som ekvation (1a) inverterad.
| En syra kan förstås som en kemisk förening som har förmågan i vattenlösning H3 för att bilda O-joner eller för att omvandla OH-joner till vattenmolekyler. En bas har å andra sidan förmågan att bilda OH-joner eller H3 i vattenlösning O till H2 O. |
Många ämnen som kallas syror är vattenlösningar från början och kan inte lätt förstås som kemiska föreningar som har joniskt bundna väteatomer. Saltsyra är en vattenlösning av gasen väteklorid (HCl) och anses vara en stark syra. I denna lösning - före någon praktisk användning av syran - existerar redan jämvikten (4), där jämvikten är nästan helt på höger sida.
Klorväte har för länge sedan uttömt sin potential att vara en syra och H3 O-joner bildades. De kemiska effekterna som uppstår vid praktisk applicering av saltsyra beror på reaktioner av H3 tillskrivas O-joner. Syran är H3 O-jon. pH-värdet är här måttet på surheten (koncentrationen), medan vid svagare syror, som ättiksyra, är måttet på syrastyrkan, pKa-värdet, i förgrunden. Starka och svaga syror skiljer sig i sin tendens "liknar" eller "mindre lika" H3 för att bilda O-jon i vatten. Avsnittet syra-basbalans beskriver dessa tendenser mer i detalj.
| Den kemiska effekten vid praktisk användning av en syra är mestadels på H3 O joner tillbaka. Man kan betrakta oxoniumjonerna som den viktigaste syran. |
Syra-basbalans
Under protolys absorberar en reaktant (vanligtvis vatten) den proton som avges av syran. Detta ska särskiljas från redoxreaktionerna där elektronöverföringar sker.
Den allmänna jämviktsreaktionen av en syra HA i vattenlösning är:
Syrorna skiljer sig i sin tendens att överföra H-joner till vatten. Detta kallas syrastyrka K s betecknar och indikerar jämviktskonstanten (syrakonstanten) för syrareaktionen. Surhetskonstanten ges ofta i form av pK s -värde, vilket definieras som surhetskonstantens negativa logaritm.
Syror med stort K s -värde (liten pK s -värde) är starka syror. Om pH för en lösning som innehåller en syra är två enheter under pK s värde, endast en hundradel av H3 O-joner bildades.
Flerbasiska syror
Syror som kan dela av flera protoner kallas polyprotiska syror . Svavelsyra (H2 SO4 ) är en diprotisk (även diprotisk) fosforsyra (H3 PO4 ) en triprotonisk (även triprotonisk) syra. Försöket att frigöra de enskilda protonerna (protolys) varierar i storlek och kan beräknas med hjälp av syrakonstanten (Ks ) beskriva. I allmänhet gäller följande för de enskilda protolysstegen:Ks (I)> Ks (II)> Ks (III) (eller pKs (I)
För fosforsyra:
pKS -Värden av viktiga syror
Syra-bas-reaktioner utan vatten
Analogt med de syra-bas-reaktioner som sker i vattenlösningar och med deltagande av vatten sker reaktioner i andra medier. I vattenfri etanol sker en reaktion med väteklorid, där etanol spelar rollen som bas:
I gasfasen reagerar gaserna ammoniak och väteklorid och bildar saltet ammoniumklorid.
Förutom vatten kan även andra tillräckligt polära lösningsmedel fungera som reaktanter i syra-bas-reaktioner. Ett bra exempel är autoprotolys av flytande ammoniak:
Exempel på syror
Viktiga syror är:
- Svavelsyra:H2 SO4 (industriell användning, surt regn)
- Saltsyra:HCl (industriell användning)
- Fosforsyra:H3 PO4 (Livsmedelsindustrin, inklusive cola, genetiskt material)
- Kolsyra:H2 CO3 (livsmedelsindustri, teknik, atmosfär)
- Ättiksyra:CH3 COOH (livsmedelsindustrin)
- Fluorvätesyra:HF (tillverkning av datorchip)
- Salpetersyra:HNO3 (industriell användning)
Salter av flerbasiska syror kan också fungera som syror ("sura salter"), till exempel
- Bisulfater
- Vätefosfater
Referenser
Historisk utveckling av syror:
- Claus Priesner, Karin Figala:Alchemy:Encyclopedia of a hermetic science. Beck, München 1998, ISBN 3406441068
- V. Karpenko, J.A. Norris:Vitriol in the History of Chemistry. Chem. Listy, volym 96, 2002, sidor:997-1005 [2]
- Givatorer i Britannica
- Lista över syror
- baser
- Syra-baskoncept