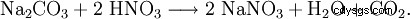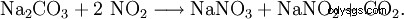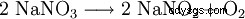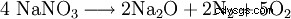| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Nåväl | |||||||
| Allmänt | |||||||
| Namn | Natriumnitrat | ||||||
| Andra namn |
| ||||||
| Molekylformel | NaNO3 | ||||||
| CAS-nummer | 7631-99-4 | ||||||
| Kort beskrivning | färglöst kristallint fast ämne | ||||||
| Egenskaper | |||||||
| Molarmassa | 84,99 g mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 2,26 g cm | ||||||
| Smältpunkt | 306,8 °C | ||||||
| Kokpunkt | Nedbrytning från 380 °C | ||||||
| Ångtryck | <0,001 hPa (25°C) | ||||||
| Löslighet | lättlöslig i vatten:874 g/l (vid 20 °C) | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | inte angivet | ||||||
| LD50 | 1267 mg kg (råtta, oral) | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Natriumnitrat (även Natronnitrat eller chilensk salpeter ) är en kemisk förening, natriumsaltet av salpetersyra. I sitt rena tillstånd är det i form av en hygroskopisk (vattenattraherande) vit substans eller färglösa kristaller.
Förekomster
Natriumnitrat är det viktigaste naturligt förekommande nitratet. Huvudorten är Chile, därav det vanliga namnet Chile salpeter. Det finns andra naturliga fyndigheter i Egypten, Mindre Asien, Colombia och Kalifornien.
Extraktion
Naturliga avlagringar renas från främmande ämnen genom filtrering av heta saltlösningar som erhålls genom urlakning med varmt vatten. Natriumnitratet som kristalliserar ut i kylan har en renhet på cirka 98%. Jodatet i moderluten används för jodextraktion.
Natriumnitrat kan också erhållas genom att reagera natriumkarbonat med salpetersyra:
Absorptionen av restgaser från oxidationen av ammoniak i en koncentrerad natriumkarbonatlösning är idealisk här:
För att oxidera nitriten surgörs den med salpetersyra, oxideras till nitrat i luft och neutraliseras med natriumkarbonat. Det koncentreras till en fast substans i vakuumindunstare.
Egenskaper
Fysiska egenskaper
- Viktiga termodynamiska egenskaper
- Δf Hs :15,5 i kJ/mol
- Ss :116 in J/(mol K)
Kemiska egenskaper
I varm svavelsyra omvandlas den till natriumvätesulfat med bildning av salpetersyra:
Vid temperaturer över 380 °C sönderdelas det till natriumnitrit:
Vid temperaturer över 800 °C till natriumoxid:
Användning
- Gödsel
- Byggmaterialindustri:cementtillsats
- Kemisk tillverkning:Kaliumnitrat
- Tidigare även använt för att producera salpetersyra
- som konserveringsmedel E 251
- för att torka kött och korvprodukter (även med natriumnitrit E 250 och kaliumnitrit E 249)
- PCM för termisk lagring
Livsmedelstillsats
Nitrat verkar mot bakterier, särskilt mot den fruktade botulismpatogenen (Clostridium botulinum). Under härdningsprocessen omvandlas det kemiskt mindre stabila muskelpigmentet (myoglobin) till en mer stabil variant (rodnad). Som ett resultat behåller köttet sin röda färg. Obehandlat kött och korv får en grå färg som för de flesta konsumenter misstas som en indikation på förstörelse. Dessutom bildas en typisk arom under härdningen.
Natriumnitrat används till korvar, hårdostar, halvhårda ostar, inlagd sill och skarpsill.
Nitrater i sig är ofarliga. Deras användning är problematisk eftersom de omvandlas till nitriter. Denna omvandling är möjlig i mat, men även i människokroppen Nitriter har en kärlvidgande och blodtryckssänkande effekt. I högre doser kan de leda till akuta symtom på förgiftning. (Brist på blodpigmentet hemoglobin =blått beroende). Nitrit kan omvandlas till mycket cancerframkallande nitrosaminer i människokroppen med samtidig absorption av protein.
Bevis
- Detektionsreaktioner
- Natrium:som ljusgul i den blå bunsenbrännarlågan
- Nitrat:Lös spatelspetsen på ämnet i utspädd svavelsyra och tillsätt en kall, mättad järn(II)sulfatlösning. Underlägg med lite koncentrerad svavelsyra. En brun ring bildas vid gränsskiktet, vilket är ett bevis på nitrat (ringtest).
Källor
- ↑ BGIA GESTIS ämnesdatabas:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 juni 2007