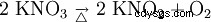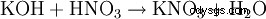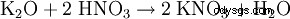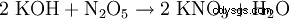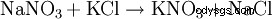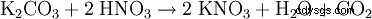| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| K | |||||||
| Allmänt | |||||||
| Namn | Kaliumnitrat | ||||||
| Andra namn |
| ||||||
| Molekylformel | KNO3 | ||||||
| CAS-nummer | 7757-79-1 | ||||||
| Kort beskrivning | vitt kristallint pulver | ||||||
| Egenskaper | |||||||
| Molarmassa | 101,11 g mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 2,109 g cm (16 °C) | ||||||
| Smältpunkt | 334 °C | ||||||
| Kokpunkt | Nedbrytning>400 °C | ||||||
| Löslighet | bra i vatten (316 g/L vid 20 °C), dålig på opolära lösningsmedel | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Kaliumnitrat , mer känd som Saltpeter i vanligt språkbruk , särskilt som kaliumnitrat , är kaliumsaltet av salpetersyra.
Egenskaper
Kaliumnitrat bildar färglösa kristaller, som löses upp i vatten under stark kylning. Det är därför mycket lättare lösligt i varmt vatten än i kallt vatten. Upp till 130 g kaliumnitrat kan lösas i 1 liter vatten vid 0°C, och upp till 2455g kaliumnitrat i 1 liter vatten vid 100°C. Vid så höga koncentrationer är lösningens densitet betydligt högre än för rent vatten.
Kaliumnitrat sönderdelas till kaliumnitrit och syre vid upphettning:
Det är ett utmärkt oxidationsmedel vid förhöjda temperaturer. Förkolnade rester i glas löser sig snabbt i smält kaliumnitrat.
Kaliumnitrat är betydligt mindre hygroskopiskt än många andra nitrater, t.ex. B. Natriumnitrat.
Extraktion
- Naturliga händelser
Kaliumnitrat (min. "Nitrokalit") förekommer som blomningar på jordar. Fyndigheterna i Kina och Sydostasien var av ekonomisk betydelse, där man under första hälften av 1800-talet utvann mer än 10 000 ton salpeter årligen genom urlakning av sådana jordar.
- Bakteriell nitrifikation av kväverikt organiskt avfall Från slutet av 1300-talet till 1800-talet framställdes salpeter i Europa med hjälp av bakterier och atmosfäriskt syre för att vara oberoende av att importera denna råvara, som är oumbärlig i krigssyfte. (se "Historik"). Organiskt avfall rikt på kväve (dynga och urin) blandas med kalk och träaska (potaska) och lämnas att sönderdelas i lösa, luftgenomsläppliga jordhögar. Kväveföreningarna omvandlas till nitrater av bakterier. Efter två år lakas massan ut med vatten. Kalium tillsätts till råluten och omvandlar därigenom kalcium- och magnesiumnitrat till kaliumnitrat och det svårlösliga jordalkalikarbonatet. Kaliumnitrat erhålls genom att indunsta den filtrerade luten, som sedan renas genom omkristallisation.
- Konverteringssalpeter
Från mitten av 1800-talet fram till omkring 1920 var omvandlingen av chilensk nitrat med kaliumklorid den viktigaste processen för framställning av kaliumnitrat:NaNO3 + KCl --> KNO3 + NaCl
Den lätta ökningen av natriumklorids löslighet med temperaturen används här:moderluten till KNO3 -Kristallisation i föregående cykel upphettas och tillsätts med rånatriumnitrat och kaliumklorid i stökiometriskt förhållande. Blandningen koncentreras med tillsats av lite soda vid 100°C, varvid natriumklorid och föroreningar (alkaliska jordartsmetallkarbonater) fälls ut och avfiltreras. Filtratet späds igen med kondensatet från indunstningen för att undvika utfällning av natriumsalter under kylning, filtreras klart och kyls sedan till 5°C för att kristallisera kaliumnitratet och centrifugeras. Det separerade kaliumnitratet omkristalliseras för tekniska ändamål.
- Syntetiskt från salpetersyra
Idag produceras kaliumnitrat syntetiskt (se Representation ).
Utseende (hantverk)
Det finns många sätt att representera kaliumnitrat:
- genom nästan alla saltbildningsreaktioner:
- från kaliumkarbonat:
Användning
- Kaliumnitrat används för att konservera mat (härdningssalt E 252)
- Används för att producera svartkrut och andra pyrotekniska blandningar
- En blandning av 24 % bor + 71 % KNO3 + 5 % bindemedel (PMMA) fungerar som en pålitlig antändningsblandning som även brinner vid mycket låga temperaturer (-196°C).
- En blandning av 60 % NaNO3 +40 % KNO3 smälter vid 222°C och används som värmeöverföringsmedium i solvärmekraftverk. Detta smälta salt är kemiskt stabilt upp till 590 °C, har en hög specifik värmekapacitet på 1,55 kJ/(kg K), en densitet på 1,79 g/cm³ och är tunn som vatten (viskositet:2,1 mPa s). Den väter mycket lätt metallytor, vilket kan leda till tätningsproblem om konstruktionen och materialvalet är olämpligt. Rostfria stål är till stor del resistenta mot nitratsmältor (erosionshastighet:6 - 15 µm/år vid 570 °C). Värmeöverföringskoefficienten vid det turbulenta flödesröret är ca 6000 W/K m². På grund av sin höga värmekapacitet (2,8 MJ/(K m³)) är saltpetersmältan även lämplig som värmelagringsmedium. Smälttemperaturen kan sänkas ytterligare genom att tillsätta natriumnitrit. En saltblandning av 53 % KNO3 kallad HiTec + 40 % NaNO2 + 7 % NaNO3 smälter vid 140°C och har särskilt gynnsamma egenskaper som värmeöverföringsmedium om toxiciteten hos natriumnitrit är irrelevant.
- Salpeterbad används för värmebehandling av bearbetade aluminiumlegeringar med en magnesiumhalt på upp till 10 %. Den högsta tillåtna temperaturen för det smälta saltet beror på magnesiumhalten; den sjunker från 550 °C vid 0,5 % Mg till 380 °C vid 10 % Mg.
- i rökgranater
- i gödselmedel
Historik
Redan på 1000-talet nämns salpeter i Marcus Graecus bok, som också nämner svartkrutsblandningen för första gången, som ett nytt ämne som skrapas bort jord och stenar. Boken från det sena 1200-talet om strid på berg och användning av krigsmaskiner av Hassan ar-Rammah (Al-Furusiyya wa al-Manasib al-Harbiyya ) innehåller redan flera bestämmelser för rengöring av salpetern med träaska och för att förbereda brandanordningar och bränsle för raketer.
Salpeter importerades ursprungligen från Indien; Venedig drog stora vinster från mellanhandeln. Med ökande efterfrågan och av självständighetsskäl främjade regeringar från slutet av 1300-talet sin egen produktion av salpeter och säkrade alla rättigheter till produktion, import och användning med hjälp av drakoniska lagar genom en "salpeterregim". På grund av den snabba frigöringen av syre var salpetern grunden för den plötsliga förbränningen av svavel och träkol i krut och därför, som en kroniskt knapp substans, den strategiska råvaran under sex århundraden.
I Thüringen fanns det nio salpeterverk på 1500-talet. Vltavas strand nära Prag täcktes med "sanitetsbänkar", och staden Halle beviljade en koncession för att utvinna salpeter från soptippen. Den ökande efterfrågan på salpeter möttes delvis av ytterligare import, främst från Indien, och av egna anläggningar.
Från slutet av 1300-talet odlades salpeterträdgårdar systematiskt. Djuravfall (dynga, avföring, urin och blod) fylldes med kalkrik jord, jord från kyrkogårdar eller slakterier eller från myrar och med kalk, bråte och aska i gropar eller staplades upp och hälldes då och då med flytande gödsel eller urin. Efter ett eller två år producerade nedbrytningen så mycket salpeter att den kunde tvättas ur jorden. Utbytet var ca 6:1, dvs 1 kg salpeter erhölls från 6 kg nitratjord.
Salpeterpannor som ett speciellt och mycket impopulärt yrke fick när som helst gå in i fastigheter och söka efter salpeter där. Detta gällde även för kyrkor på 1600- och 1700-talen, exklusive tider för tillbedjan. I Sverige fick bönderna till och med betala en del av sin skatt i salpeter.
På 1800-talet var det till och med ett nitratkrig, som Chile utkämpade mot sina grannländer för att få ensam besittning av de enorma ökenfyndigheterna av natriumnitrat ("Caliche"), som nu omedelbart kunde omvandlas med kaliumsalter för att bilda kaliumnitrat. Denna omvandlingsprocess ersattes slutligen från 1916 av Haber-Bosch-processen för att generera ammoniak från luft och vatten med efterföljande omvandling till salpetersyra.
Källor
- ↑ Post om kaliumnitrat i ämnesdatabasen GESTIS för BGIA, hämtad den 3 september 2007 (JavaScript krävs)
Referenser
- Perry, R.H., Chemical Engineers' Handbook, 4:e upplagan, McGraw-Hill Book Company, New York, 1963, s. 9-77
- Janz, GH, et al., Physical Properties Data Compilations Relevant to Energy Storage II. Molten Salts, NSRDS, april, 1979
- Gartz, J, sprängämnens kulturhistoria, E.S.Mittler &Son, Hamburg, 2006