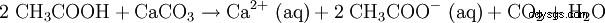| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allmänt | |||||||
| Namn | Ättiksyra | ||||||
| Andra namn |
| ||||||
| Molekylformel | C2 H4 O2 | ||||||
| CAS-nummer | 64-19-7 | ||||||
| Kort beskrivning | färglös vätska med en stickande lukt | ||||||
| Egenskaper | |||||||
| Molarmassa | 60,05 g mol | ||||||
| Sakens tillstånd | flytande | ||||||
| Densitet | 1,05 g cm | ||||||
| Smältpunkt | 17°C | ||||||
| Kokpunkt | 118°C | ||||||
| Ångtryck | 16hPa (20°C) | ||||||
| pKa-värde | 4,75 | ||||||
| Löslighet | fullständigt blandbar med vatten (20 °C) | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | ej specificerat | ||||||
| Termodynamiska egenskaper | |||||||
| ΔHf | -483,52 kJ mol | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Ättiksyra , enligt IUPAC-förordningen etansyra , är en färglös, flytande, kaustik karboxylsyra med en typisk vinägerdoft. Som livsmedelstillsats har den beteckningen E260. Vattenlösningar av ättiksyra kallas trivialt endast ättika och koncentrerad ättiksyra isättika. Det latinska namnet för ättiksyra är Acidum aceticum . Salterna av ättiksyra kallas acetater utsedda. Inom biokemi är termen acetat att föredra framför den för ättiksyra, eftersom ättiksyra till stor del deprotonerar under fysiologiska förhållanden som acetatanjonen (CH3 COO) är närvarande.
Erhålla och visa
Klassisk ekologisk produktion
Den klassiska produktionen av ättiksyra är jäsning. Acetobacter-bakterier omvandlar etanolen (alkoholen) som produceras av andra jäsningsprocesser till ättiksyra (jäsningsvinäger). Startprodukter kan t.ex. t.ex. vin, öl eller malt.Hushållsvinäger består av jäsningsvinäger eller utspädd syntetisk vinäger och innehåller 5 % ättiksyra. Vinegar Essence är en 25 % syntetisk ättiksyralösning i vatten, har en stark stickande lukt och får endast användas utspädd i mat.
Kemisk tillverkning i stor skala
Den viktigaste industriella syntesen av ättiksyra är den katalytiska omvandlingen av metanol med kolmonoxid under tryck (Monsanto-processen).
CH3OH + CO → CH3COOH
Förutom detta kan ättiksyra också syntetiseras genom oxidation av acetaldehyd med luft eller syre med hjälp av Mn(OAc)2 som katalysator eller genom partiell oxidation av andra kolväten.
Tekniskt sett används även luftoxidation av n-butan vid cirka 180 °C och 85 bar och katalytisk oxidation av lättbensin.
Egenskaper
Fysiska egenskaper
När ättiksyra löses i vatten dissocierar ungefär var hundrade ättiksyramolekyl och bildar en acetatjon. Den avdelade protonen överförs till en vattenmolekyl. Oxoniumjonerna som bildas i denna process orsakar de sura egenskaperna hos ättiksyralösningarna.
Vid 118 °C har ättiksyra en relativt hög kokpunkt jämfört med polära ämnen med en jämförbar molmassa (t.ex. 1-propanol:kokpunkt 97 °C). Anledningen till detta är ättiksyramolekylernas förmåga att via sina karboxylgrupper bilda två "ömsesidiga" vätebindningar, så att dimerer bildas av två ättiksyramolekyler, som beter sig som en molekyl med två gånger molmassan. Därför krävs en högre mängd energi för överföringen av dessa dimerer till gasfasen, vilket känns igen på den "ökade" koktemperaturen.
Kemiska egenskaper
Ättiksyra oxiderar helt i luften och bildar vatten och koldioxid.
Basmetaller som magnesium, kalcium, zink eller järn löses i utspädd ättiksyra för att bilda vattenlösliga acetater och frigöra väte.
Ättiksyra reagerar med koppar i närvaro av syre (luft) och bildar kopparacetat, ett grönt, skadligt salt bättre känt som ärg.
Ättiksyra reagerar med etanol och bildar etylacetat, ett allmänt använt lösningsmedel. Att ersätta etanol med 1-pentanol ger amylacetat, som är en starkt luktande ester. Salicylsyra kan också förestras med ättiksyra. Detta producerar acetylsalicylsyra, den aktiva ingrediensen i aspirin.
Ättiksyra reagerar vid 800 °C med uttorkning till ättiksyraanhydrid.
Utspädd ättiksyra används också för att lösa upp kalk (se vinäger). Reaktionsekvationen ser ut så här:
Termodynamiska egenskaper
Standardentropin för vätskan vid en bar (Sl, 1 bar ) är 158,0 J mol K, det för det fasta ämnet (Ss). ) 282,84 J mol K.
Användning
Ättiksyra är av stor betydelse som smakämne. Ättiksyra och dess salter kaliumacetat (E 261), natriumacetat (E 262) och kalciumacetat (E 263) används som surgöringsmedel för frukt och grönsaker i burkar och burkar (0,5–3 % ättiksyra), för alla typer av fisk, sylt, olika marinader, delikatesssallader, majonnäs, salladsdressingar tillsammans med sorbinsyra (E 200) eller bensoesyra (E 210) och för inläggning och tvättning av färskt kött.
Den bakteriedödande effekten av ättiksyra är att det ändrade pH-värdet förhindrar fysiologiska processer och även denaturerar proteiner.
Ättiksyra används också vid tillverkning av kosmetika (krämer, tvålar).
Salter av ättiksyra (acetater)
Salterna eller estrarna av ättiksyra kallas acetater utsedda. De är oftast färglösa kristallina salter som innehåller acetatanjonen (CH3 COO).
Exempel på saltliknande acetater är natriumacetat (NaCH3 COO), kaliumacetat (KCH3 COO) eller bly(II)acetat (Pb(CH3 COO)2 ).
De saltliknande acetaterna erhålls genom att neutralisera ättiksyran med metallhydroxider eller metalloxider:
-
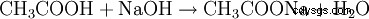
- Ättiksyra och natriumhydroxid reagerar och bildar natriumacetat och vatten.
-
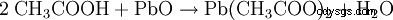
- Ättiksyra och bly(II)oxid producerar blyacetat och vatten.
Vid kemisk analys kan acetater lätt detekteras genom att mala provet med kaliumvätesulfat i en mortel. I denna process överförs protonen (H) av vätesulfatjonen till acetatjonen, vilket producerar flyktig ättiksyra, som lätt kan identifieras genom dess karakteristiska lukt:
-

- Acetat protoneras av vätesulfat. Ättiksyra och sulfat bildas.
Ättiksyraestrarna innehåller acetylradikalen som syraradikalen. Den mest kända av dessa estrar är etylacetat. Organiska acetater erhålls genom att förestra ättiksyra med alkoholer (R-OH):
-

- Ättiksyra och alkohol reagerar och bildar en ättiksyraester och vatten.
Källor
- ↑ BGIA GESTIS ämnesdatabas:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 augusti 2007