| strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| K | |||||||||
| Allmänt | |||||||||
| Namn | Kaliumnitrit | ||||||||
| Andra namn | Kaliumsalpetersyrlighet, E 249 | ||||||||
| Molekylformel | KNO2 | ||||||||
| CAS-nummer | 7758-09-0 | ||||||||
| Kort beskrivning | vitaktigt gult fast | ||||||||
| Egenskaper | |||||||||
| Molarmassa | 85,10 g mol | ||||||||
| Sakens tillstånd | fixat | ||||||||
| Densitet | 1,92 g cm | ||||||||
| Smältpunkt | 441°C | ||||||||
| Kokpunkt | Sönderdelning | ||||||||
| Löslighet | bra i vatten (2810 g/L vid 20 °C) | ||||||||
| Säkerhetsinstruktioner | |||||||||
| |||||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||||
Kaliumnitrit , KNO2 (även:Kaliumnitrat , engelska:kaliumnitrit ), är kaliumsaltet av salpetersyrlighet HNO2 .
Egenskaper
Kaliumnitrit bildar färglösa till svagt gulaktiga, mycket hygroskopiska (=fuktattraherande) kristaller som löser sig lätt i vatten vid kylning, lösningen reagerar alkaliskt. Kristallerna sönderdelas från 360 °C. Annars beter den sig på liknande sätt som natriumnitrit, dvs den är oxiderande (särskilt vid högre temperaturer) och reagerar häftigt med metaller som aluminium (särskilt i pulverform!), torra ammoniumföreningar (som ammoniumsulfat), cyanider och många organiska föreningar. Det är ett reduktionsmedel och omvandlas långsamt till kaliumnitrat KNO3 i luft oxiderad.
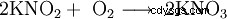
Kaliumnitrit är giftigt; i allmänhet kan nitriter reagera med vissa aminer under lämpliga förhållanden för att bilda cancerframkallande nitrosaminer. Nitrit kan detekteras med järnsulfat och koncentrerad svavelsyra genom att bli brun.
Förekomst och produktion
I naturen förekommer nitriter som mellanstadier i kvävets kretslopp – både vid nitrifikation (kvävebindning) och vid denitrifikation (kvävefrisättning) Tekniskt sett erhålls kaliumnitrit genom inverkan av kväveoxider på kaliumhydroxidlösning.
Användning
Kaliumnitrit får användas som livsmedelstillsats under nummer E 249 (Konserveringsmedel) kan användas under vissa förhållanden i nitrithärdningssaltet (natriumklorid med kaliumnitrit och natriumnitrit). Det ger köttet en permanent röd färg genom bildandet av nitrosomyoglobin. Kött- och korvprodukter kan innehålla en multipel av dricksvattengränsen för nitrit.
Källor
- ↑ Post för CAS-nr. 7758-09-0 i ämnesdatabasen GESTIS för BGIA, hämtad den 14 december 2007 (JavaScript krävs)



