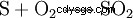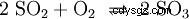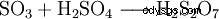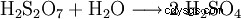| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Generale | |||||||
| Nome | Acido solforico | ||||||
| Altri nomi | acido solforico(VI), olio di vetriolo, diidrosolfato, acido monotionico | ||||||
| Formula molecolare | H2 SO4 | ||||||
| Numero CAS | 7664-93-9 | ||||||
| Breve descrizione | liquido incolore e inodore, leggermente viscoso | ||||||
| Proprietà | |||||||
| Massa molare | 98,08 g mol | ||||||
| Stato della materia | liquido | ||||||
| Densità | 1,8356 g cm | ||||||
| Punto di fusione | 10,38°C | ||||||
| Punto di ebollizione | 279,6 °C | ||||||
| Pressione di vapore | 1,3 hPa (145,8 °C) | ||||||
| Solubilità | completamente miscibile con acqua | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| MAC | 0,1 mg m (misurata come frazione di aerosol inalabile) | ||||||
| LD50 | 2140 mg kg (ratto) | ||||||
| WGK | 1 - leggermente pericoloso per l'acqua | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Acido solforico (secondo IUPAC:Diidrogenosolfato ) è un liquido viscoso incolore e un acido inorganico forte. È uno degli acidi minerali ed è una delle 20 sostanze chimiche più importanti nell'industria chimica. Come additivo alimentare ha il numero E 513 .Diluire l'acido solforico prende il nome di acido diluito. Fino al 19° secolo, l'acido solforico aveva anche il nome banale di olio di vetriolo (derivato dai vetrioli), che oggi non è più utilizzato.
I sali e gli esteri dell'acido solforico sono chiamati solfati e idrogeno solforati. I solfati simili al sale contengono lo ione solfato (SO4 ).
Ottenere e visualizzare
In passato, l'acido solforico veniva prodotto utilizzando il processo al vetriolo e il processo a camera di piombo. I metodi moderni sono il metodo del contatto e il metodo del doppio contatto sviluppato da esso.
Il processo più antico per la produzione di acido solforico è il processo al vetriolo. Fu usato dagli alchimisti nel XIII secolo. I vetrioli sono solfati relativamente facili da decomporre termicamente per formare anidride solforosa e un ossido di metallo. Johann Rudolph Glauber (1604–1670) costruì la prima manifattura di acido solforico al mondo, che utilizzò questo processo per produrre acido solforico intorno al 1650 a Nordhausen (Harz).
Nel processo di contatto, la produzione avviene in tre fasi, a partire dallo zolfo elementare (S) e dall'ossigeno (O2 ) Anidride solforosa (SO2 ) viene visualizzato:
L'anidride solforosa viene ulteriormente ossigenata con pentossido di vanadio (V2 O5 ) come catalizzatore, ad anidride solforosa (SO3 ) implementato:
Il triossido di zolfo è l'anidride dell'acido solforico. A causa della sua bassa solubilità in acqua, non viene introdotto direttamente nell'acqua ma nell'acido solforico concentrato, dal quale viene assorbito molto bene.
L'acido disolforico formatosi viene diluito in continuo con acqua.
Proprietà
Acido solforico con formula molecolare H2 SO4 è un acido forte (pKS1 =-3, pKS2 , che corrisponde a pKS dell'anione solfato di idrogeno HSO4 =1,9). Essendo un forte acido inorganico, è uno degli acidi minerali. L'acido solforico concentrato è anche un potente agente ossidante. È anche igroscopico e può quindi essere utilizzato per essiccare gas e liquidi. La molecola di acido solforico tetraedrica distorta ha un grande momento di dipolo, il cui polo positivo si trova tra i due gruppi OH.
L'acido solforico forma un azeotropo con l'acqua. Se si porta a ebollizione acido solforico al 100%, l'anidride solforosa evapora fino a raggiungere una concentrazione di circa il 98% in peso. Al contrario, l'acido solforico diluito può essere portato a questa concentrazione facendolo bollire.
L'acido solforico al 100% viene preparato facendo gorgogliare triossido di zolfo in circa il 98% in peso di acido solforico fino a renderlo anidro. L'acido solforico può anche legare grandi quantità di anidride solforosa, il liquido risultante è chiamato oleum a causa della sua elevata viscosità. Oleum è costituito da una miscela di acido solforico e acidi polisolfurici (acido disolforico:H2 S2 O7 , acido trisolforico H2 S3 O10 , ecc.) È disponibile in commercio oleum con fino al 65% in peso di anidride solforosa. L'oleum viene utilizzato nelle reazioni chimiche per la solfonazione o quando è necessario legare quanta più acqua possibile dalla reazione. Ciò riduce al minimo il consumo di acido solforico e spesso massimizza la resa.
Per determinare la concentrazione, viene misurata la densità dell'acido solforico. La concentrazione può quindi essere dedotta direttamente dalle tabelle standard. Ad esempio, viene determinato lo stato di carica di una batteria per auto (vedi anche batteria al piombo).
Quando si diluisce l'acido solforico concentrato, viene rilasciato molto calore. Pertanto, devono essere adottate adeguate misure precauzionali. È importante che sempre l'acido l'acqua è mischiato, cioè non l'acqua dell'acido ! In caso contrario, l'acqua può evaporare in modo esplosivo, facendo schizzare via il liquido in modo incontrollabile; il pericolo è evidente. Il mnemonico:"Prima l'acqua, poi l'acido, altrimenti accadrà il mostruoso."
Significato e uso
L'acido solforico è una delle sostanze chimiche più comunemente prodotte. Nel 1997 sono state prodotte più di 130 milioni di tonnellate in tutto il mondo. Le possibili applicazioni sono molto diverse. Viene utilizzato acido solforico
- per la digestione di minerali (ad es. nella digestione di ossido di titanio(IV) o uranio)
- per la produzione di solfati
- per la produzione di altri acidi (es. acido fluoridrico o acido fosforico)
- per la produzione di fertilizzanti tramite acido nitrico
- per la produzione di tensioattivi
- come catalizzatore
- per il trattamento dei metalli
- come essiccante
- come coadiuvante di reazione (acido nitrato)
- nelle batterie per auto
- per l'incisione di semiconduttori
- per la sua conduttività come additivo per l'acqua nell'elettrolisi
- come solvente quando si fuma
- in analisi per determinare i numeri di viscosità della poliammide
- per la produzione di biossido di titanio
Nell'industria alimentare, l'acido solforico viene utilizzato come additivo tecnico per produrre amido modificato e caseina e per trattare l'acqua potabile. Non fluisce nel prodotto finale e quindi non è presente o è presente solo in tracce innocue per la salute. Nell'Unione Europea, l'acido solforico non deve essere dichiarato sulla confezione del prodotto.
La dissoluzione del permanganato di potassio in acido solforico fino a saturazione produce un liquido oleoso verde scuro (epossido di manganese) che è un forte agente ossidante. Carbonizza immediatamente materiali organici come il legno e brucia spontaneamente con acetone o altri combustibili. Dissolvendo il dicromato di potassio nell'acido solforico si ottiene l'acido solforico cromico, una sostanza comunemente usata in passato per la pulizia nei laboratori.
La quantità di acido solforico prodotta era un indicatore dell'efficienza dell'industria chimica di un paese. Grandi quantità di acido solforico vengono consumate nella II fase di sviluppo dell'industria chimica.
Fasi di sviluppo:
- I. Consumo predominante di soda caustica
- II. Consumo predominante di acido solforico III. consumo prevalente di cloro
Struttura e legame
Nella molecola di acido solforico, come nell'anione idrogeno solforato, l'atomo di zolfo ha una coordinazione tetraedrica distorta. I due legami SO ai gruppi OH sono notevolmente più lunghi rispetto ai due atomi di ossigeno "nudo". Le lunghezze di legame trovate corrispondono a ordini di legame di 1 e 2. Nella notazione usata frequentemente con doppi legami (covalenti) e senza cariche formali, tuttavia, il legame dei quattro atomi di ossigeno allo zolfo non può essere spiegato senza utilizzare gli orbitali 3d di utilizzare lo zolfo per i legami π (cfr. PSE). Tuttavia, considerazioni teoriche dettagliate mostrano che gli orbitali d contribuiscono poco al legame nei composti degli elementi del gruppo principale. Il legame più breve con gli atomi di ossigeno "nudo" è quindi meglio descritto come un legame singolo covalente, che è accorciato da interazioni elettrostatiche aggiuntive. La separazione delle cariche può essere derivata dalla singola struttura di confine mesomerica che obbedisce alla regola dell'ottetto.
Prova
L'acido solforico può essere rilevato sotto forma di anione solfato. Ad esempio, la precipitazione come solfato di bario microcristallino scarsamente solubile dopo l'aggiunta di una soluzione di cloruro di bario serve come rilevamento del solfato.
Collegamenti importanti
Sali:
- Solfato di rame (vetriolo di rame)
- Solfato di calcio (gesso, alabastro, anidrite) (CaSO4 )
- Solfato di bario (barite, longarone) (BaSO4 )
- Allume (solfati misti di alluminio con altri cationi)
- alluminio
- Solfato ferroso (vetriolo ferroso)
- Solfato di sodio (sale di Glauber)
Esteri:
- dimetilsolfato (solvente, agente metilante; molto tossico)
Fonti
- ↑ Voce sull'acido solforico nel database delle sostanze GESTIS del BGIA, recuperato il 31 marzo 2007 (JavaScript richiesto)
- Acido solforoso H2 SO3 (diidrogeno solfito)
- Punto di rugiada dell'acido solforico