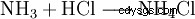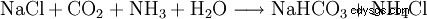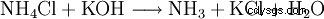| Strukturformel | ||||||||
|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||
| Nome | Cloruro di ammonio | |||||||
| Andere Nome |
| |||||||
| Summenformel | NH4 Cl | |||||||
| Numero CAS | 12125-02-9 | |||||||
| Kurzbeschreibung | weiße Kristalle | |||||||
| Eigenschaften | ||||||||
| Massa Molare | 53,49 g·mol | |||||||
| Aggregatzustand | festa | |||||||
| Dichte | 1.526 g·cm | |||||||
| Schmelzpunkt | 335 °C | |||||||
| Siedepunkt | zerfällt | |||||||
| Dampfdruck | 1,3 hPa (160,4 °C) | |||||||
| Löslichkeit | budello in Wasser (372 g/L bei 20°C) | |||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||
cloruro di ammonio (NH4 Cl) ist ein weißes, gut wasserlösliches Salz, welches kubische Kristalle bildet.
Mit steigender Temperatur dissoziiert Ammoniumchlorid zunehmend zu Ammoniak und Chlorwasserstoff. Bei 340 °C sublimiert der Stoff vollständig. Unter Druck (34,4 bar) schmilzt Ammoniumchlorid bei 520 °C.Als Lebensmittelzusatz trägt es die Nummer E 510.
Vorkommen
Natürlich vorkommendes Ammoniumchlorid ist als Mineral Salmiak bekannt und verbreitet. Der Name "Salmiak" leitet sich von lat. "sal ammoniacum " (Salz des Ammon, siehe auch Namensherkunft von Ammoniak) ab, da es im Altertum in der Nähe eines Ammon-Tempels im heutigen Ägypten vorkam und mit Halit (Steinsalz) verwechselt wurde.
Gewinnung e Darstellung
Ammoniumchlorid kann durch Neutralization von wässriger Ammoniaklösung mit Salzsäure oder durch die Reaktion von gasförmigem Ammoniak mit gasförmigen Chlorwasserstoff gewonnen werden. Es kann durch Umkristalliseren aus Wasser gereinigt werden.
Ammoniumchlorid fällt als Nebenprodukt bei der Gewinnung von Soda nach dem Solvay-Verfahren an.
Eigenschaften
Ammoniumchlorid ist gut in Wasser löslich. Wässrige Lösungen reagieren sauer. Der pH-Wert einer 1%igen Lösung beträgt etwa 5,5. Es ist schlecht in Ethanol löslich und unlöslich in Aceton und Ether.
Beim Versetzen von Ammoniumchlorid mit Starken Basen wird gasförmiges Ammoniak freigesetzt.
Verwendung
Verwendung findet Ammoniumchlorid heute unter anderem zur Herstellung von Kältemischungen, in der Färberei und Gerberei. Ebenfalls findet es Anwendung beim Verzinnen, Verzinken oder Löten, da es die Fähigkeit besitzt, mit Metalloxiden flüchtige Chloride zu bilden und somit die Metalloberfläche zu reinigen. Des Weiteren dient es in der Medizin als Expektorans und wird als Elektrolyt in Zink-Kohle-Batterien eingesetzt; Außerdem a Salmiak-Lakritz. Es ist auch häufig in Rauchpulver (weiß) vorhanden.
Calma
- ↑ BGIA GESTIS Stoffdatenbank:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15. agosto 2007
Letteratura
- Pradyot Patnaik:Manuale di prodotti chimici inorganici . McGraw-Hill, New York 2002 ISBN 0-07-049439-8 (inglese)