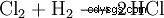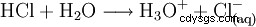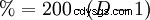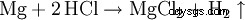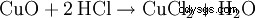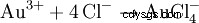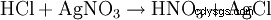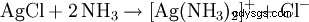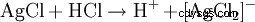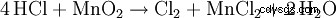| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Nessuna formula strutturale disponibile | |||||||
| Generale | |||||||
| Nome | Acido cloridrico | ||||||
| Altri nomi |
| ||||||
| Formula molecolare | Non applicabile | ||||||
| Numero CAS | 7647-01-0 | ||||||
| Breve descrizione | liquido da incolore a giallastro con odore pungente | ||||||
| Proprietà | |||||||
| Massa molare | Non applicabile | ||||||
| Stato della materia | liquido | ||||||
| Densità | 1,19 g cm (soluzione al 37%) | ||||||
| Punto di fusione | -35 ° C (soluzione al 36%) | ||||||
| Punto di ebollizione | 57 °C (soluzione al 36%) | ||||||
| Pressione di vapore | 127 hPa (20 °C, soluzione al 36%) | ||||||
| Solubilità | L'acido cloridrico può essere sciolto in acqua fino a una concentrazione del 37% | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| MAC | 2 ml mo 3,0 mg m | ||||||
| WGK | 1 - leggermente pericoloso per l'acqua | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Acido cloridrico (nome sistematico acido cloridrico ) è una soluzione acquosa del gas acido cloridrico (formula chimica HCl). È un acido forte, inorganico ed è uno degli acidi minerali. I sali dell'acido cloridrico sono chiamati cloruri. Il cloruro più noto è il cloruro di sodio (NaCl, sale comune).
Cronologia
L'acido cloridrico doveva essere noto ai primi alchimisti. La loro scoperta è attribuita a Maria Prophetissa nel I secolo e Geber nel IX secolo.
Già nella prima metà del XV secolo Basilio Valentino ottenne l'acido cloridrico facendo reagire l'alite (salgemma) con vetriolo ferroso. Johann Rudolph Glauber riuscì a produrlo da sale da cucina e acido solforico nel XVII secolo. Lavoisier chiamò acido cloridrico acide muriatique (lat. muria =salamoia). Le sorgenti saline sono ancora chiamate sorgenti muriatiche designato. In Nord America, l'acido cloridrico è anche chiamato acido muriatico chiamato.
Occorrenze
In natura, l'acido cloridrico si trova nei gas vulcanici e in soluzione diluita nei laghi vulcanici. Si presenta in forma libera nel succo gastrico dei vertebrati (da 0,1 a 0,5 percento in massa). I depositi di sali dell'acido cloridrico sono quasi inesauribili, come salgemma e disciolti in acqua di mare.
Ottenere e visualizzare
L'acido cloridrico è prodotto in laboratorio da acido solforico concentrato e sale comune (da cui il nome):
L'acido solforico sposta l'acido cloridrico dal suo sale, sebbene l'acido cloridrico sia l'acido più forte. Ciò è possibile perché l'acido cloridrico è gassoso e praticamente insolubile in acido solforico. Di conseguenza, l'acido cloridrico scompare costantemente dall'equilibrio. Il solfato risultante è solfato di sodio, un sale acido.
Nell'industria chimica, l'acido cloridrico ad alta purezza si ottiene bruciando gas detonante cloro (una miscela di idrogeno e cloro).
Per completare l'acido, sciogliere il gas acido cloridrico in acqua:
L'acido cloridrico tecnicamente puro è principalmente un sottoprodotto della clorazione dei composti organici.
Proprietà
| % HCl | g HCl/l | Molarità | Densità |
|---|---|---|---|
| 10.5 | 110 | 3.06 | 1.050 |
| 15.5 | 166 | 4.61 | 1.075 |
| 20.4 | 224 | 6,22 | 1.100 |
| 22,3 | 248 | 6.89 | 1.110 |
| 24,3 | 272 | 7.56 | 1.120 |
| 26,2 | 296 | 8,22 | 1.130 |
| 28,2 | 321 | 8.92 | 1.140 |
| 30,1 | 347 | 9.64 | 1.150 |
| 32,1 | 372 | 10,23 | 1.160 |
| 34,2 | 400 | 11,11 | 1.170 |
| 36,2 | 428 | 11.89 | 1.180 |
| 38,3 | 456 | 12.67 | 1.190 |
| 40,4 | 485 | 13,47 | 1.200 |
A 0 °C, il gas HCl si dissolve molto bene in acqua (se l'acqua è ancora in fase liquida) (815 go 507 l in un litro). Questo crea calore. A 25 °C, un litro di acido cloridrico saturo contiene 825 g di HCl (42,7%). La densità della soluzione è 1,20 g cm. La dipendenza dalla concentrazione della densità è mostrata nella tabella adiacente. Esiste una connessione matematica casuale tra la densità e il contenuto percentuale di HCl:i decimali raddoppiati corrispondono alla concentrazione, ad es. B. 1,10 g cm è la densità del 20% di acido cloridrico.
L'acido cloridrico con un contenuto di HCl superiore al 36% in peso è anche chiamato acido cloridrico fumante denotato perché una nebbia bianca si forma su vasi aperti.
L'acido cloridrico puro può essere evaporato senza lasciare residui. Se viene riscaldato acido cloridrico con un contenuto di HCl superiore al 20% in peso, fuoriesce più HCl dell'acqua, fino a quando rimane una miscela di 20% di HCl e 80% di acqua, nota come azeotropo. Il contenuto esatto di HCl nell'azeotropo a 1013 mbar è 20,17%, il punto di ebollizione è 110 °C.
L'HCl si dissocia completamente in acqua, l'acido cloridrico concentrato (32%) ha un valore di pH di -1. Nell'aria umida, il gas HCl forma una nebbia di fini goccioline di acido cloridrico.
L'acido cloridrico diluito è un buon conduttore di elettricità.
Reazioni
L'acido cloridrico dissolve la maggior parte dei metalli ad eccezione dei metalli preziosi come ad es. tantalio (germanio), rame e mercurio (solo in presenza di ossigeno) e argento per formare cloruri e idrogeno se non protetti da passivazione.
È molto adatto per rimuovere rapidamente la ruggine dall'acciaio, poiché gli ossidi metallici reagiscono con l'acido cloridrico formando cloruri e acqua:
Una miscela di acido cloridrico e acido nitrico è chiamata aqua regia perché può sciogliere anche l'oro, il "re dei metalli". Oltre all'effetto ossidante del cloruro di nitrosile e del cloro nascente, contribuisce anche la riduzione della concentrazione effettiva di ioni oro attraverso la formazione di complessi:
Utilizzo
L'acido cloridrico è di grande importanza nell'industria chimica come acido inorganico. L'acido cloridrico viene utilizzato, ad esempio, nella lavorazione dei minerali e del fosfato naturale. Viene utilizzato nel trattamento acido dei pozzi di petrolio e gas e nella lavorazione dei metalli per il decapaggio, l'incisione e la saldatura.
L'acido cloridrico è un reagente importante nell'analisi chimica. È in grado di separare un gruppo di metalli da altri metalli mediante precipitazione. Questi possono quindi essere ulteriormente analizzati separatamente (vedi; gruppo acido cloridrico). L'alcalimetria è un'altra area di utilizzo dell'acido cloridrico.
Come additivo alimentare, l'acido cloridrico porta la denominazione E 507.
Importanza biologica
Nell'uomo e negli animali, l'acido cloridrico è un componente del succo gastrico, dove provoca, tra l'altro, l'idrolisi dei grassi, ma serve anche a uccidere i germi prima che entrino nell'ulteriore sistema digestivo.
Istruzioni di sicurezza
Il contatto con la pelle provoca ustioni chimiche. I vapori sono irritanti In caso di contatto con gli occhi, lavare immediatamente e abbondantemente con acqua e consultare un medico. In caso di incidente o di malessere, consultare immediatamente un medico.
Prova
L'acido cloridrico è rilevato da un lato dal suo carattere acido. Inoltre, l'anione cloruro viene identificato in una soluzione altamente diluita per precipitazione con nitrato d'argento sotto forma di cloruro d'argento:
Il precipitato bianco risultante si dissolve in acqua ammoniacale o in acido cloridrico concentrato con la formazione di un complesso:
Se l'acido cloridrico viene riscaldato in presenza di biossido di manganese si produce cloro gassoso:
Il contenuto percentuale di acido cloridrico è determinato mediante titolazione con soda caustica (→ acidimetria, analisi volumetrica). Tale determinazione, oltre a quella dei cloruri, può essere effettuata fotometricamente utilizzando il sale di mercurio dell'acido cloranilico. Il contenuto di acido cloridrico nel succo gastrico viene determinato utilizzando il reagente di Günzburg.
Riferimenti
- ↑ Voce sull'acido cloridrico nel database delle sostanze GESTIS del BGIA, recuperato il 16 dicembre 2007 (JavaScript richiesto)
- ↑ Nils Wiberg, Egon Wiberg, Arnold P. Holleman:Libro di testo di chimica inorganica , 101a edizione, p.460 segg., Gruyter 1995, ISBN 978-3-11-012641-9