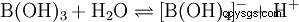| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Generale | |||||||
| Nome | acido borico | ||||||
| Altri nomi | Borofax | ||||||
| Formula molecolare | H3 BO3 | ||||||
| Numero CAS | 10043-35-3 | ||||||
| Breve descrizione | polvere bianca | ||||||
| Proprietà | |||||||
| Massa molare | 61,83 g/mol | ||||||
| Stato della materia | risolto | ||||||
| Densità | 1,44 g/cm | ||||||
| Punto di fusione | Si decompone a 185°C | ||||||
| Punto di ebollizione | non esiste | ||||||
| Pressione di vapore | 2,7 hPa (20 °C) | ||||||
| Solubilità | 50 g/l in acqua | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| MAC | nessuno | ||||||
| LD50 | 2660 mg/kg | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
acido borico (anche:acido ortoborico ), H3 BO3 , è l'acido ossigeno più semplice del boro, i suoi sali sono chiamati borati. (Precedentemente chiamato anche idrossido di boro)
Proprietà
L'acido borico puro forma cristalli squamosi, incolori e lucenti che hanno un punto di fusione di 171 °C. Inizialmente è difficile da sciogliere in acqua, ma questo processo accelera con l'aumentare della concentrazione. La soluzione reagisce debolmente acida. Con il metanolo si forma un estere metilico dell'acido borico volatile, anche senza acido solforico concentrato, che brucia con una fiamma verde e viene utilizzato per il rilevamento qualitativo del boro.
Quando l'acido ortoborico viene riscaldato, l'acqua viene scissa e si forma l'acido metaborico HBO2, che si presenta in diverse modificazioni ed infine, con ulteriore eliminazione dell'acqua, il triossido di diboro B2 O3 .
Nonostante i suoi tre atomi di idrogeno, l'acido borico reagisce come un acido monoprotico in acqua, producendo lo ione tetraidroxoborato, B(OH)4 . Qui non si comporta come un acido di Brønsted come donatore di protoni, ma come un acido di Lewis come accettore di idrossido:
L'acido borico è un acido molto debole (pKs =9,25). Per reazione con alcoli polivalenti tali. B. mannitolo, la forza acida può essere aumentata in modo significativo. Ciò è dovuto a uno spostamento dell'equilibrio verso destra verso un derivato tetraossoborato a seguito dell'esterificazione:
Questa reazione viene utilizzata per la titolazione alcalimetrica dell'acido borico e viene utilizzata anche nella determinazione dell'azoto di Kjeldahl.Non è tossico in piccole quantità. ma i borani sono molto tossici.
Evento ed estrazione
L'acido borico libero si trova nelle sorgenti di vapore (fumarole) dell'Italia centrale in Toscana, da cui si può ottenere l'acido evaporandolo in piastrine lucide. L'acido borico si trova anche in Toscana come minerale sassolin. Tuttavia, i sali alcalini e alcalino terrosi, come il minerale kernite Na2, sono di grande importanza B4 O7 · 4H2 O. Un minerale simile e più raro è il borace, che contiene 8 o 10 equivalenti di acqua cristallina. Al giorno d'oggi, però, questo si ottiene principalmente dal kernit. Trattando il borace con acido cloridrico o acido solforico, l'acido borico B(OH)3 rilascio.
Utilizzo
La soluzione acquosa ("acqua di perforazione") funge da disinfettante delicato ed è anche approvata come conservante E284. L'acido borico è un intermedio utilizzato nella produzione di vetro borosilicato, porcellana, smalto e si trova anche nei ritardanti di fiamma e nei mordenti. La produzione mondiale annuale di acido borico supera i 200 kilotoni.
Un'altra applicazione dell'acido borico è nelle centrali nucleari con reattori ad acqua pressurizzata. Lì, l'acido borico viene utilizzato a causa dell'elevato coefficiente di assorbimento dei neutroni termici dell'isotopo B-10, che è presente nel boro naturale al 20 percento, per controllare il fattore di moltiplicazione k e quindi la potenza del reattore.
Inoltre, l'acido borico viene utilizzato per calcolare la CO2 -Salario utilizzato sulla terra nei tempi antichi. In un ambiente acido, più boro viene incorporato nell'acido borico. Quando il pH diventa alcalino, l'acido borico si converte in borato, il sale dell'acido borico. Poiché i foraminiferi (fossili e organismi unicellulari recenti) necessitano di borato per costruire il loro guscio, la relazione può essere utilizzata per determinare quale pH era presente in quest'area in quel momento della storia della terra. Poiché i gusci di tali protozoi, nonché le cozze, ecc. costituiscono la parte principale del sedimento marino, le carote di sedimento possono essere semplicemente prelevate da lì ed esaminate in laboratorio per i due isotopi del boro. Tali risultati si correlavano bene con le bolle d'aria intrappolate nelle carote di ghiaccio.
L'acido borico combinato con il metanolo produce un colore verde fiamma; in connessione con altri alcanoli un bordo di fiamma verde. Questa proprietà è molto utilizzata negli spettacoli di fuoco, ad esempio per colorare bastoncini di fiamma, pois o bracieri.
Fonti
- ↑ Scheda di sicurezza dei materiali (Merck)