| Borace | |
| Cristalli di borace dalla California | |
| Chimica | Na2 [B4 O5 (OH)4 ] · 8H2 O |
| Classe minerale | Gruppo borati V/H.10-30 (dopo Strunz) 26.4.1.1 (dopo Dana) |
| Sistema di cristallo | monoclinico |
| Classe di cristallo | monoclino-prismatico 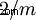 |
| Colore | incolore, bianco, grigio, giallo, verde |
| Colore tratto | bianco |
| Durezza Mohs | da 2 a 2,5 |
| Densità (g/cc) | 1.72 |
| Splendi | Vitreo a opaco |
| Trasparenza | trasparente a opaco |
| Frazione | conchiglia |
| Scollatura | perfetto |
| Habitus | cristalli corti prismatici o tabulari, aggregati colonnari, terrosi, granulari, massicci |
| Facce di cristallo comuni | |
| Gemellaggio | |
| Aspetto cristallo | |
| Indice di rifrazione | α=1.447 β=1.469 a 1.470 γ=1.472 |
| Birifrangenza (orientamento ottico) | Δ=0,025; Da 39° a 40°, biassiale negativo |
| pleocroismo | incolore |
| Angolo/dispersione degli assi ottici | 2vz ~ |
| Proprietà aggiuntive | |
| Transizioni di fase | |
| Punto di fusione | 878 °C |
| Comportamento chimico | solubile in acqua e glicerina |
| Minerali simili | kernite, colemanite, sassolina, soda, trona |
| Radioattività | non radioattivo |
| Magnetismo | non magnetico |
| Segni distintivi | |
Borace , noto anche come Tinkal , Borato di sodio o dal suo nome chimico Tetraborato di disodio decaidrato noto, è un minerale borato piuttosto raro dalla classe minerale dei borati del gruppo. Cristallizza nel sistema cristallino monoclino con la formula chimica Na2 [B4 O5 (OH)4 ] · 8H2 O o Na2 B4 O7 · 10H2 O o Na2 O x 2 B2 O3 · 10H2 O e sviluppa per lo più cristalli corti, prismatici o tabulari, ma anche aggregati terrosi, granulari o massicci, per lo più di colore bianco o grigio. Occasionalmente è incolore.
Proprietà speciali
Se riscaldato a circa 100 °C, perde parte della sua acqua di cristallizzazione e forma un pentaidrato. Sopra i 400 °C si ottiene tetraborato di sodio anidro, che fonde a 878 °C. La massa molare del tetraborato di sodio è 201,22 g mol, quella del decaidrato è 381,37 g mol. La densità della sostanza anidra è 2,37 g cm, quella del decaidrato è 1,72 g cm.
Etimologia e Storia
Il borace fu descritto per la prima volta nel 1748 dal mineralogista svedese Johan Gottschalk Wallerius. Il nome deriva dalla parola araba bauraq per "bianco". Era già utilizzato nell'antichità in Cina per gli smalti e in Egitto per l'imbalsamazione.
Formazione e località
Il borace si trova in natura in forma cristallina o solida simile all'anidrite o al gesso come evaporite, cioè è formato dall'essiccamento dei laghi salati, che vengono poi chiamati anche laghi di borace, e quindi si presenta come sedimento. Può anche essere trovato nelle prese d'aria vulcaniche.
Un evento naturale è a Boron, in California, dove viene estratto a cielo aperto. Altre località includono Kırka in Turchia, nonché Borax Lake e Searles Lake/California negli Stati Uniti.
Oggi il borace si ottiene quasi esclusivamente dal minerale di borace kernit, che ha meno acqua cristallina.
Utilizzo
come materia prima
Il borace è una materia prima importante per la produzione di acido borico, per la produzione di borati e perborati nonché di altri composti di boro. Il borace è utilizzato per smalti su terracotta, ceramica, porcellana, vetro e nella produzione di smalti.
Il suo utilizzo come fondente nella brasatura di metalli preziosi, nonché nella saldatura e nella forgiatura si basa sul suo effetto di rimozione degli ossidi (antiossidante).
Il borace è un ingrediente base nella realizzazione del giocattolo Slime, insieme ad alcol polivinilico, acqua distillata e colorante alimentare.
in chimica
Numerosi ossidi metallici si dissolvono nella massa fusa del borace, formando colori caratteristici e, dopo il raffreddamento, formano una perla simile al vetro, la perla di borace. Questi coloranti vengono utilizzati per identificare i cationi nel processo di separazione dei cationi.
Il colore verde della fiamma che si verifica quando il metanolo viene bruciato con borace ed è causato dal trimetil borato è un semplice indicatore del metanolo.
Inoltre, il borace viene utilizzato per soluzioni tampone (tamponi borato e borato-fosfato) e nella soluzione di borace-carminio (soluzione Grenachers ) usato come colorante in microscopia.
in casa
In casa, il borace viene utilizzato nei saponi, negli addolcitori d'acqua e come perborato nei detersivi, nei disinfettanti, nei detersivi e nelle candeggine, nonché negli insetticidi (per le trappole per formiche).
Inoltre, il borace agisce come conservante preventivo del legno contro muffe e insetti e viene utilizzato per circa l'uno per cento della quantità totale consumata come ritardante di fiamma, qui principalmente per materiali isolanti a base di cellulosa. In quest'ultima applicazione, le sue proprietà sono viste come parzialmente problematiche e una riduzione è considerata sensata.
Come additivo alimentare, ha la denominazione E 285.
Precauzioni
[[Aiuto:Cache|Errore durante la creazione della miniatura]]:Il borace può causare infiammazioni se viene a contatto con la pelle o gli occhi o se la polvere fine viene inalata. L'ingestione può causare irritazione del tratto gastrointestinale; quantità maggiori sono mortali (frasi R e S:R:36/37-62, S:22-26-36/37/39-45).
Il numero CAS del tetraborato di sodio anidro è 1330-43-4, pentaidrato 1332-28-1 e borace (tetraborato di sodio decaidrato) 1303-96-4.
- Sistematica dei minerali
- Elenco dei minerali
Prove individuali
- ↑ Webmineral - Borace
- ↑ MinDat - Borace
- ↑ Voce sul tetraborato di sodio nel database delle sostanze GESTIS del BGIA, recuperato il 25 settembre 2007 (JavaScript richiesto)
- ↑ Martin Okrush, Siegfried Matthes:mineralogia . 7a edizione. Springer Verlag, Berlino 2005, ISBN 3-540-23812-3
- ↑ Enciclopedia di base compatta Römpp della chimica . A cura di Jürgen Falbe e Manfred Regitz. A cura di Eckard Amelingmeier et al. Thieme, Stoccarda/New York 1998, ISBN 3-13-115711-9
- ↑ Pigmenti Kremer - Borace
- ↑ Università di Bayreuth – Esperimenti sugli effetti:Slime
- ↑ Leisewitz et al. Rapporto di ricerca n° 297 44 542 per conto dell'Agenzia federale dell'ambiente (dicembre 2000), pag. 121 e segg.
Riferimenti
- Edizione Dörfler:Enciclopedia dei minerali , Nebel Verlag, ISBN 3-89555-076-0
