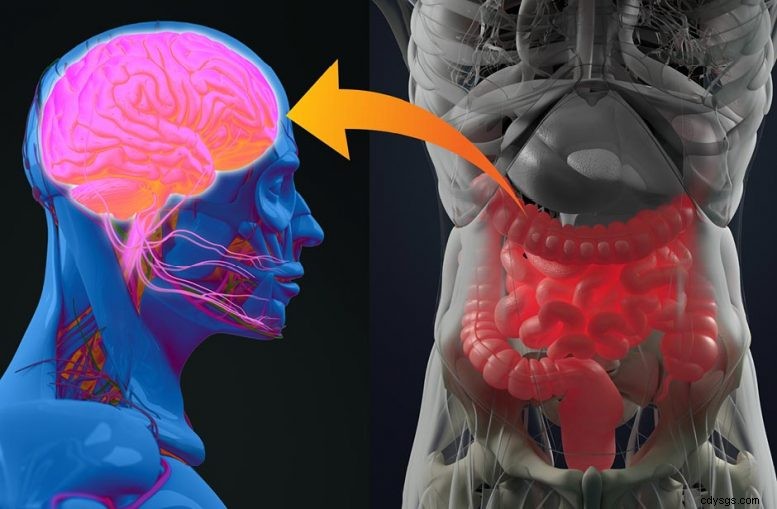
Patrice Cani (UCLouvain) et Claude Knauf (INSERM) ont découvert un « brouilleur » qui bloque la communication entre l'intestin et le cerveau, empêchant ainsi une bonne régulation du sucre et provoquant une résistance à l'insuline chez les personnes atteintes de diabète. Ils ont également découvert qu'un lipide produit par notre corps aide à prévenir ce dysfonctionnement et à réguler le taux de sucre, atténuant ainsi le diabète et l'inflammation intestinale. Ces découvertes, publiées dans la revue scientifique GUT, sont majeures, car aujourd'hui un Européen sur deux est en surpoids et un sur dix est diabétique. Crédit :UCLouvain
Depuis 2004, Claude Knauf (INSERM) et Patrice Cani (Université Catholique de Louvain) collaborent sur les mécanismes moléculaires et cellulaires afin de comprendre les causes du développement du diabète de type 2 et surtout d'identifier de nouvelles cibles thérapeutiques. En 2013, ils ont créé un laboratoire international, "NeuroMicrobiota Lab" (INSERM-UCLouvain), pour identifier les liens entre le cerveau et les bactéries intestinales.
Très vite, ils ont compris que l'axe intestin-cerveau joue un rôle prépondérant dans la régulation du sucre dans le sang. Lorsque nous mangeons, l'intestin (également appelé « deuxième cerveau » en raison des neurones qui le composent) se contracte et digère les aliments. Le sucre et les graisses pénètrent dans l'organisme et leur taux augmente dans le sang. En utilisant ce sucre et ces graisses, le corps fait alors son travail ou les stocke. Chez une personne diabétique, ce processus fonctionne mal et le taux de sucre augmente dans des proportions anormales.
Poussant un peu plus loin, les deux chercheurs ont observé que l'intestin, lorsqu'il digère, envoie un signal au cerveau, pour savoir quoi faire avec les graisses et les sucres entrants. Le cerveau envoie alors le message à différents organes (foie, muscles, tissu adipeux) pour se préparer à faire baisser le taux de sucre et de graisse dans le sang. Chez une personne diabétique, cependant, ce mécanisme ne fonctionne pas. Les chercheurs ont observé que l'intestin fonctionne mal et n'envoie aucun signal au cerveau. La cause est l'hypercontractilité de l'intestin, qui interfère avec la communication avec le cerveau. Du coup, les commandes pour faire sortir le sucre du sang ne passent plus. Le sucre reste, provoquant une hyperglycémie. Le mécanisme a également un impact sur l'action de l'insuline :pas de message signifie pas d'action de l'insuline, ce qui entraîne une résistance à l'insuline.
Les chercheurs ont cherché à comprendre cette hypercontractilité, en observant les différences de constitution de l'intestin ainsi que l'action des prébiotiques au sein du microbiote chez des souris « normales » et « diabétiques ». Ils ont observé qu'un lipide particulier était sévèrement déficient chez les souris diabétiques, mais aussi chez les personnes atteintes de diabète (bien qu'il soit naturellement présent dans les intestins des patients sains). L'équipe a donc testé l'impact du lipide sur l'utilisation des sucres, sur la contraction de l'intestin et, in fine, sur le diabète. Anne Abot et Eve Wemelle, membres de l'équipe de recherche NeuroMicrobiota, ont découvert que le lipide est la clé pour restaurer l'utilisation du sucre. Cela fonctionne en agissant directement sur le deuxième cerveau.
Aujourd'hui, l'équipe a découvert et compris comment nos bactéries intestinales (ou microbiote intestinal) jouent un rôle important dans la modification de la production de lipides bioactifs, et de là pour rétablir une parfaite communication entre l'intestin et le cerveau. Ainsi, certains de ces lipides sont des messagers essentiels qui agissent sur des cibles bien précises dans le deuxième cerveau (enképhalines ou récepteurs opioïdes). Les possibilités de traitement comprennent la modification de la production de ces lipides par l'organisme, ou leur prise par voie orale. Ces pistes sont à l'étude.
En utilisant la même approche, l'équipe de recherche INSERM-UCLouvain, a contribué à la découverte d'un nouveau lipide bioactif qui réduit l'inflammation intestinale. Il est directement produit par certaines bactéries intestinales, également identifiées dans cette étude et donc les deux approches, soit le lipide, soit une ou plusieurs bactéries, pourraient servir de cible thérapeutique.
Un humain sur trois sur les 150 000 qui meurent chaque jour est victime d'une maladie cardiovasculaire, selon l'OMS. La moitié de la population belge est en surpoids et présente des risques cardiovasculaires et de diabète de type 2. Ces recherches de l'UCLouvain et de l'INSERM pourraient potentiellement avoir un impact sur une grande partie de la population.
Référence :« Identification de nouvelles entérosynes à l'aide de prébiotiques :rôles des lipides bioactifs et de la signalisation des récepteurs mu-opioïdes chez l'homme et la souris » par Anne Abot, Eve Wemelle, Claire Laurens, Adrien Paquot, Nicolas Pomie, Deborah Carper, Arnaud Bessac, Xavier Mas Orea , Christophe Fremez, Maxime Fontanie, Alexandre Lucas, Jean Lesage, Amandine Everard, Etienne Meunier, Gilles Dietrich, Giulio G Muccioli, Cedric Moro, Patrice D Cani et Claude Knauf, 5 octobre 2020, Gut .
DOI :10.1136/gutjnl-2019-320230
Pour mener à bien cette recherche, Patrice Cani de l'UCLouvain a reçu des financements de plusieurs sources dont WELBIO, le FNRS et le Fonds Baillet-Latour.
