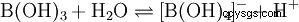| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Général | |||||||
| Nom | acide borique | ||||||
| Autres noms | |||||||
| Formule moléculaire | H3 BO3 | ||||||
| Numéro CAS | 10043-35-3 | ||||||
| Brève description | poudre blanche | ||||||
| Propriétés | |||||||
| Masse molaire | 61,83 g/mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 1,44 g/cm | ||||||
| Point de fusion | Se décompose à 185 °C | ||||||
| Point d'ébullition | n'existe pas | ||||||
| Pression de vapeur | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| LD50 | |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
acide borique (aussi :acide orthoborique ), H3 BO3 , est l'acide oxygéné le plus simple du bore, ses sels sont appelés borates. (Anciennement aussi appelé hydroxyde de bore)
Propriétés
L'acide borique pur forme des cristaux écailleux, incolores et brillants qui ont un point de fusion de 171 °C. Il est initialement difficile à dissoudre dans l'eau, mais ce processus s'accélère avec l'augmentation de la concentration. La solution réagit faiblement acide. Un ester méthylique d'acide borique volatil se forme avec du méthanol - même sans acide sulfurique concentré - qui brûle avec une flamme verte et est utilisé pour la détection qualitative du bore.
Lorsque l'acide orthoborique est chauffé, l'eau est séparée et l'acide métaborique HBO2, qui se présente sous plusieurs formes, se forme et enfin, avec une élimination supplémentaire de l'eau, du trioxyde de dibore B2 O3 .
Malgré ses trois atomes d'hydrogène, l'acide borique réagit comme un acide monoprotique dans l'eau, donnant l'ion tétrahydroxoborate, B(OH)4 . Ici, il ne se comporte pas comme un acide de Brønsted en tant que donneur de proton, mais comme un acide de Lewis en tant qu'accepteur d'hydroxyde :
L'acide borique est un acide très faible (pKs =9,25). Par réaction avec des alcools polyhydriques tels. B. mannitol, la force de l'acide peut être augmentée de manière significative. Ceci est dû à un déplacement de l'équilibre vers la droite vers un dérivé tétraoxoborate suite à une estérification :
Cette réaction est utilisée pour le titrage alcalimétrique de l'acide borique et est également utilisée dans la détermination de Kjeldahl de l'azote.Il n'est pas toxique en petites quantités. mais les boranes sont très toxiques.
Occurrence et Extraction
L'acide borique libre se trouve dans les sources de vapeur (fuméroles) du centre de l'Italie en Toscane.L'acide peut être obtenu à partir de ces sources en l'évaporant en plaquettes brillantes. L'acide borique est également présent en Toscane sous le nom de sassolin minéral. Cependant, les sels alcalins et alcalino-terreux, tels que le minéral kernite Na2, sont d'une grande importance B4 O7 · 4H2 O. Un minéral similaire, plus rare, est le borax, qui contient 8 ou 10 équivalents d'eau cristalline. De nos jours, cependant, cela est principalement obtenu à partir de kernit. En traitant le borax avec de l'acide chlorhydrique ou de l'acide sulfurique, l'acide borique B(OH)3 relâcher.
Utilisation
La solution aqueuse ("eau de forage") sert de désinfectant doux et est également approuvée comme conservateur E284. L'acide borique est un intermédiaire utilisé dans la fabrication du verre borosilicaté, de la porcelaine, de l'émail, et se trouve également dans les retardateurs de flamme et les mordants. La production mondiale annuelle d'acide borique est supérieure à 200 kilotonnes.
Une autre application de l'acide borique est dans les centrales nucléaires avec des réacteurs à eau sous pression. Là, l'acide borique est utilisé en raison du coefficient d'absorption élevé des neutrons thermiques de l'isotope B-10, présent dans le bore naturel à 20 %, pour contrôler le facteur de multiplication k et donc la puissance du réacteur.
De plus, l'acide borique est utilisé pour calculer le CO2 -Salaire utilisé sur terre dans les temps anciens. Dans un environnement acide, plus de bore est incorporé dans l'acide borique. Lorsque le pH devient alcalin, l'acide borique se transforme en borate, le sel de l'acide borique. Étant donné que les foraminifères (fossiles ainsi que les organismes unicellulaires récents) ont besoin de borate pour construire leur coquille, la relation peut être utilisée pour déterminer quel pH était présent dans cette zone à quel moment de l'histoire de la Terre. Étant donné que les coquilles de ces protozoaires ainsi que les moules, etc. constituent la majeure partie des sédiments marins, des carottes de sédiments peuvent simplement être prélevées à partir de là et examinées en laboratoire pour les deux isotopes du bore. De tels résultats étaient bien corrélés avec les bulles d'air emprisonnées dans les carottes de glace.
L'acide borique combiné au méthanol produit une couleur de flamme verte; en liaison avec d'autres alcanols une bordure de flamme verte. Cette propriété est très utilisée dans les spectacles de feu, par exemple pour colorer des bâtons de flammes, des pois ou des bols à feu.
Origine
- ↑ Fiche de données de sécurité (Merck)