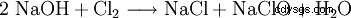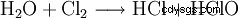| formule structurelle | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Général | ||||||||
| Nom | Hypochlorite de sodium | |||||||
| Autres noms | ||||||||
| Formule moléculaire | NaOCl | |||||||
| Numéro CAS | 7681-52-9 | |||||||
| Brève description | solide jaune avec une odeur désagréable et sucrée | |||||||
| Propriétés | ||||||||
| Masse molaire | 74,44 g mol | |||||||
| État de la matière | corrigé | |||||||
| Densité | 1,2 g cm (solution de chlore libre à 13 %) | |||||||
| Point de fusion | 24,5 °C (pentahydraté) | |||||||
| Pression de vapeur | ||||||||
| Solubilité | ||||||||
| Consignes de sécurité | ||||||||
| ||||||||
| WGK | 2 – dangereux pour l'eau | |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | ||||||||
Hypochlorite de sodium (NaOCl) est le sel de sodium de l'acide hypochloreux (également appelé hypochloreux) (HClO). Il s'agit d'une poudre blanche qui contient normalement six moles d'eau de cristallisation par mole d'hypochlorite de sodium. Le nom commun de la solution aqueuse d'hypochlorite de sodium est Eau de Labarraque ou Eau de Javel , où l'étiquette Eau de Javel est strictement incorrect. Il s'agit d'une solution d'hypochlorite de potassium, éventuellement en mélange avec d'autres sels comme le chlorure de potassium; cependant, il n'est souvent pas distingué.
Obtention/Représentation
L'hypochlorite de sodium est produit en introduisant du chlore gazeux dans de la soude caustique ou en électrolysant une solution de chlorure de sodium.
Cette réaction pose des problèmes techniques importants. Puisqu'il s'agit formellement d'une hydrolyse du chlore selon
avec la neutralisation ultérieure de l'acide chlorhydrique ou de l'acide hypochloreux résultant, il est facile de voir que les enthalpies de réaction de ces réactions conduisent à un fort échauffement, auquel tous les hypochlorites sont sensibles. En fait, le même procédé chimique est utilisé pour fabriquer du chlorate, mais en le faisant réagir en solution chaude. Pour cette raison, tous les hypochlorites techniques contiennent des quantités variables, parfois importantes, de chlorate. La réaction de l'hypochlorite produit lors de la production avec le chlore conduit finalement au chlorate.
Utilisation
Le but de l'utilisation est de blanchir ou de désinfecter (par exemple dans les piscines). L'utilisation en piscine n'est pas sans problème, car les quantités à doser doivent être suffisantes pour chlorer l'ammoniac présent (ou les amines) au-delà du niveau de la monochloramine, car c'est alors seulement qu'une désinfection adéquate est garantie.
L'hypochlorite de sodium est également le principal ingrédient actif des nettoyants ménagers désinfectants et blanchissants tels que DanKlorix et bien d'autres. Divers produits anti-moisissure contiennent également cet ingrédient actif.
L'hypochlorite de sodium est également utilisé en dentisterie. Par exemple, il est utilisé dans le traitement radiculaire des dents infectées par des bactéries pour les désinfecter.
Consignes de sécurité
Une extrême prudence est requise lors de la manipulation de l'hypochlorite de sodium ! Il existe un risque d'explosion lorsque l'hypochlorite de sodium réagit avec de nombreuses substances et groupes de substances, notamment des agents réducteurs, des amines, de l'acide formique, du méthanol, des substances organiques et quelques autres. Attaque fortement les muqueuses en cas d'inhalation.
De plus, l'hypochlorite de sodium réagit avec les acides (ex. acide chlorhydrique, acide nitrique) et les agents oxydants (ex. peroxyde d'hydrogène, permanganate) parfois très violemment, générant de la chaleur et dégageant du chlore gazeux et/ou des gaz nitreux.
La chaleur ou la lumière du soleil seules peuvent provoquer la décomposition de l'hypochlorite de sodium, libérant du chlore, du chlorure d'hydrogène, du dioxyde de chlore et de l'oxygène, entre autres. Ceci doit également être pris en compte lors du stockage de la substance.
Origine
- ↑ Base de données des substances BGIA GESTIS :https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 12 mai. 2007