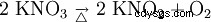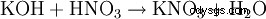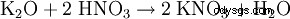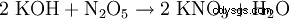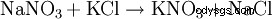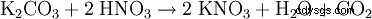| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| K | |||||||
| Général | |||||||
| Nom | Nitrate de potassium | ||||||
| Autres noms |
| ||||||
| Formule moléculaire | CONNAISSANCE3 | ||||||
| Numéro CAS | 7757-79-1 | ||||||
| Brève description | poudre cristalline blanche | ||||||
| Propriétés | |||||||
| Masse molaire | 101,11 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 2,109 g·cm (16 °C) | ||||||
| Point de fusion | 334 °C | ||||||
| Point d'ébullition | Décomposition>400 °C | ||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Nitrate de potassium , mieux connu sous le nom de Salpêtre dans le langage courant , en particulier sous forme de nitrate de potassium , est le sel de potassium de l'acide nitrique.
Propriétés
Le nitrate de potassium forme des cristaux incolores qui se dissolvent dans l'eau avec un fort refroidissement. Il est donc beaucoup plus facilement soluble dans l'eau chaude que dans l'eau froide. Jusqu'à 130g de nitrate de potassium peuvent être dissous dans 1 litre d'eau à 0°C, et jusqu'à 2455g de nitrate de potassium dans 1 litre d'eau à 100°C. À des concentrations aussi élevées, la densité de la solution est nettement supérieure à celle de l'eau pure.
Le nitrate de potassium se décompose en nitrite de potassium et en oxygène lors du chauffage :
C'est un excellent agent oxydant à des températures élevées. Les résidus carbonisés dans la verrerie se dissolvent rapidement dans le nitrate de potassium fondu.
Le nitrate de potassium est nettement moins hygroscopique que de nombreux autres nitrates, par ex. B. Nitrate de sodium.
Extraction
- Occurrences naturelles
Le nitrate de potassium (min. "Nitrokalit") se produit sous forme d'efflorescence sur les sols. Les gisements en Chine et en Asie du Sud-Est étaient d'une importance économique, où dans la première moitié du XIXe siècle, plus de 10 000 tonnes de salpêtre étaient extraites chaque année par lessivage de ces sols.
- Nitrification bactérienne des déchets organiques riches en azote De la fin du XIVe au XIXe siècle, le salpêtre est produit en Europe à l'aide de bactéries et de l'oxygène atmosphérique afin de s'affranchir de l'importation de cette matière première indispensable à la guerre. (voir "Historique"). Les déchets organiques riches en azote (excréments et urines) sont mélangés à de la chaux et de la cendre de bois (potasse) et laissés à se décomposer en tas de terre meuble et perméable à l'air. Les composés azotés sont transformés en nitrates par les bactéries. Après deux ans, la masse est lessivée avec de l'eau. De la potasse est ajoutée à la lessive brute, convertissant ainsi le nitrate de calcium et de magnésium en nitrate de potassium et en carbonate alcalino-terreux peu soluble. Le nitrate de potassium est obtenu par évaporation de la lessive filtrée, qui est ensuite purifiée par recristallisation.
- Conversion salpêtre
Du milieu du 19ème siècle jusque vers 1920, la conversion du nitrate chilien avec du chlorure de potassium était le processus le plus important pour la production de nitrate de potassium :NaNO3 + KCl --> KNO3 + NaCl
On utilise ici la légère augmentation de la solubilité du chlorure de sodium avec la température :la liqueur mère de KNO3 -La cristallisation du cycle précédent est chauffée et additionnée de nitrate de sodium brut et de chlorure de potassium en rapport stoechiométrique. Le mélange est concentré avec addition d'un peu de soude à 100°C, au cours de laquelle du chlorure de sodium et des impuretés (carbonates de métaux alcalino-terreux) précipitent et sont filtrés. Le filtrat est à nouveau dilué avec le condensat de l'évaporation afin d'éviter la précipitation de sels de sodium lors du refroidissement, essoré puis refroidi à 5°C pour cristalliser le nitrate de potassium et centrifugé. Le nitrate de potassium séparé est recristallisé à des fins techniques.
- Synthétique à partir d'acide nitrique
Aujourd'hui, le nitrate de potassium est produit par synthèse (voir Représentation ).
Apparence (Artisanat)
Il existe plusieurs façons de représenter le nitrate de potassium :
- par presque toutes les réactions de formation de sel :
- de carbonate de potassium :
Utilisation
- Le nitrate de potassium est utilisé pour conserver les aliments (sel de cure E 252)
- Utilisé pour produire de la poudre noire et d'autres mélanges pyrotechniques
- Un mélange de 24 % de bore + 71 % de KNO3 + 5 % de liant (PMMA) sert de mélange d'allumage fiable qui brûle également à très basse température (-196 °C).
- Un mélange de 60 % de NaNO3 +40 % de KNO3 fond à 222°C et est utilisé comme fluide caloporteur dans les centrales solaires thermiques. Ce sel fondu est chimiquement stable jusqu'à 590 °C, a une capacité thermique spécifique élevée de 1,55 kJ/(kg K), une densité de 1,79 g/cm³ et est aussi fluide que l'eau (viscosité :2,1 mPa·s). Il mouille très facilement les surfaces métalliques, ce qui peut entraîner des problèmes d'étanchéité si la construction et le choix des matériaux ne sont pas adaptés. Les aciers inoxydables sont largement résistants à la fonte des nitrates (taux d'érosion :6 - 15 µm/an à 570 °C). Le coefficient de transfert de chaleur au tuyau d'écoulement turbulent est d'environ 6000 W/K m². En raison de sa capacité calorifique élevée (2,8 MJ/(K m³)), la fonte de salpêtre convient également comme milieu de stockage de chaleur. La température de fusion peut être encore réduite en ajoutant du nitrite de sodium. Un mélange de sel à 53 % de KNO3 appelé HiTec + 40 % NaNO2 + 7 % NaNO3 fond à 140 °C et possède des propriétés particulièrement favorables en tant que fluide caloporteur si la toxicité du nitrite de sodium n'est pas pertinente.
- Les bains de salpêtre sont utilisés pour le traitement thermique des alliages d'aluminium corroyés avec une teneur en magnésium allant jusqu'à 10 %. La température maximale admissible du sel fondu dépend de la teneur en magnésium; il passe de 550 °C à 0,5 % de Mg à 380 °C à 10 % de Mg.
- dans des grenades fumigènes
- en engrais
Historique
Déjà au 11ème siècle, le salpêtre est mentionné dans le livre de Marcus Graecus, qui mentionne également le mélange de poudre noire pour la première fois, comme une nouvelle substance qui est grattée de la terre et des pierres. Le livre de la fin du XIIIe siècle sur le combat monté et l'utilisation des machines de guerre par Hassan ar-Rammah (Al-Furusiyya wa al-Manasib al-Harbiyya ) contient déjà plusieurs règles pour nettoyer le salpêtre avec de la cendre de bois et pour préparer des engins incendiaires et du carburant pour fusées.
Le salpêtre a été initialement importé d'Inde; Venise a tiré des profits élevés du commerce intermédiaire. Avec une demande croissante et pour des raisons d'indépendance, dès la fin du XIVe siècle, les gouvernements ont promu leur propre production de salpêtre et ont obtenu tous les droits de production, d'importation et d'utilisation au moyen de lois draconiennes à travers un "régime du salpêtre". En raison de la libération rapide d'oxygène, le salpêtre a été à la base de la combustion soudaine du soufre et du charbon de bois dans la poudre à canon et donc, en tant que substance chroniquement rare, la matière première stratégique pendant six siècles.
En Thuringe, il y avait neuf salpêtres au XVIe siècle. Les berges de la Vltava près de Prague sont couvertes de "bancs sanitaires", et la ville de Halle accorde une concession pour extraire le salpêtre des dépotoirs. La demande croissante de salpêtre a été en partie satisfaite par de nouvelles importations, principalement d'Inde, et par nos propres usines.
Dès la fin du XIVe siècle, les jardins de salpêtre sont systématiquement cultivés. Les déjections animales (excréments, excréments, urine et sang) étaient remplies de terre calcaire, de terre de cimetières ou d'abattoirs ou de tourbières et de chaux, de gravats et de cendres dans des fosses ou entassées et parfois déversées avec du lisier ou de l'urine. Au bout d'un an ou deux, la décomposition a produit tellement de salpêtre qu'il a pu être lavé de la terre. Le rendement était d'environ 6:1, c'est-à-dire que 1 kg de salpêtre a été obtenu à partir de 6 kg de terre de nitrate.
Les chaudières à salpêtre en tant que profession spéciale et très impopulaire étaient autorisées à entrer dans les propriétés à tout moment et à y rechercher du salpêtre. Cela était vrai même pour les églises des XVIIe et XVIIIe siècles, à l'exclusion des périodes de culte. En Suède, les agriculteurs devaient même payer une partie de leurs impôts en salpêtre.
Au XIXe siècle, il y a même eu une guerre des nitrates, que le Chili a menée contre ses pays voisins afin de s'emparer seul des immenses gisements désertiques de nitrate de sodium ("Caliche"), qui pouvaient désormais être convertis immédiatement avec des sels de potasse pour former nitrate de potasse. Ce procédé de conversion a finalement été remplacé à partir de 1916 par le procédé Haber-Bosch de génération d'ammoniac à partir de l'air et de l'eau avec conversion ultérieure en acide nitrique.
Origine
- ↑ Entrée sur le nitrate de potassium dans la base de données des substances GESTIS du BGIA, récupérée le 3 septembre 2007 (JavaScript requis)
Références
- Perry, R.H., Chemical Engineers' Handbook, 4e éd., McGraw-Hill Book Company, New York, 1963, p. 9-77
- Janz, GH, et al., Compilations de données sur les propriétés physiques pertinentes pour le stockage d'énergie II. Sels fondus, NSRDS, avril 1979
- Gartz,J, histoire culturelle des explosifs, E.S.Mittler &Son, Hambourg, 2006