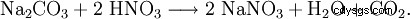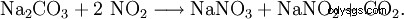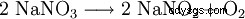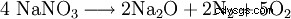| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Eh bien | |||||||
| Général | |||||||
| Nom | Nitrate de sodium | ||||||
| Autres noms |
| ||||||
| Formule moléculaire | NaNO3 | ||||||
| Numéro CAS | 7631-99-4 | ||||||
| Brève description | solide cristallin incolore | ||||||
| Propriétés | |||||||
| Masse molaire | 84,99 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 2,26 g cm | ||||||
| Point de fusion | 306,8 °C | ||||||
| Point d'ébullition | Décomposition à partir de 380 °C | ||||||
| Pression de vapeur | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| MAK | |||||||
| LD50 | |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Nitrate de sodium (également nitrate de natron ou salpêtre chilien ) est un composé chimique, le sel de sodium de l'acide nitrique. À l'état pur, il se présente sous la forme d'une substance blanche hygroscopique (attirant l'eau) ou de cristaux incolores.
Occurrences
Le nitrate de sodium est le nitrate naturel le plus important. La localité principale est le Chili, d'où le nom commun de salpêtre du Chili. Il existe d'autres gisements naturels en Égypte, en Asie Mineure, en Colombie et en Californie.
Extraction
Les dépôts naturels sont débarrassés des matières étrangères par filtration des saumures chaudes obtenues par lixiviation à l'eau chaude. Le nitrate de sodium qui cristallise à froid a une pureté d'environ 98 %. L'iodate contenu dans les eaux-mères est utilisé pour l'extraction de l'iode.
Le nitrate de sodium peut également être obtenu en faisant réagir du carbonate de sodium avec de l'acide nitrique :
L'absorption des gaz résiduels de l'oxydation de l'ammoniac dans une solution concentrée de carbonate de sodium est ici idéale :
Pour oxyder le nitrite, il est acidifié avec de l'acide nitrique, oxydé en nitrate dans l'air et neutralisé avec du carbonate de sodium. Il est concentré en un solide dans des évaporateurs sous vide.
Propriétés
Propriétés physiques
- Propriétés thermodynamiques importantes
- Δf Hs :15,5 en kJ/mol
- Ss :116 en J/(mole K)
Propriétés chimiques
Dans l'acide sulfurique chaud, il est converti en hydrogénosulfate de sodium avec formation d'acide nitrique :
À des températures supérieures à 380 °C, il se décompose en nitrite de sodium :
À des températures supérieures à 800 °C à l'oxyde de sodium :
Utilisation
- Engrais
- Industrie des matériaux de construction :additif pour ciment
- Industrie chimique :nitrate de potassium
- Anciennement également utilisé pour produire de l'acide nitrique
- en tant que conservateur E 251
- pour la salaison de produits à base de viande et de charcuterie (également avec du nitrite de sodium E 250 et du nitrite de potassium E 249)
- PCM pour le stockage thermique
Additif alimentaire
Le nitrate agit contre les bactéries, en particulier contre le pathogène redouté du botulisme (Clostridium botulinum). Pendant le processus de durcissement, le pigment musculaire chimiquement moins stable (myoglobine) est converti en une variante plus stable (rougeur). En conséquence, la viande conserve sa couleur rouge. Les viandes et les saucisses non séchées prennent une couleur grise, ce qui est pris pour la plupart des consommateurs comme une indication de détérioration. De plus, un arôme typique se forme pendant l'affinage.
Le nitrate de sodium est utilisé pour les saucisses, les fromages à pâte dure, les fromages à pâte mi-dure, les harengs marinés et les sprats.
Les nitrates eux-mêmes sont inoffensifs. Leur utilisation est problématique car ils se transforment en nitrites. Cette conversion est possible dans les aliments, mais aussi dans le corps humain.Les nitrites ont un effet vasodilatateur et hypotenseur. À des doses plus élevées, ils peuvent entraîner des symptômes aigus d'empoisonnement. (Manque du pigment sanguin hémoglobine =addiction bleue). Le nitrite peut être converti en nitrosamines hautement cancérigènes dans le corps humain avec l'absorption simultanée de protéines.
Preuve
- Réactions de détection
- Sodium :jaune vif dans la flamme bleue du bec Bunsen
- Nitrate :dissoudre la pointe de la spatule de la substance dans de l'acide sulfurique dilué et ajouter une solution froide et saturée de sulfate de fer (II). Sous-couche avec un peu d'acide sulfurique concentré. Un anneau brun se forme au niveau de la couche limite, preuve de nitrate (ring test).
Origine
- ↑ Base de données des substances BGIA GESTIS :https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 juin 2007