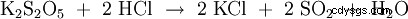| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
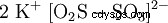 | |||||||
| Général | |||||||
| Nom | Disulfite de Potassium | ||||||
| Autres noms |
| ||||||
| Formule moléculaire | K2 S2 O5 | ||||||
| Numéro CAS | 16731-55-8 | ||||||
| Brève description | poudre incolore (blanche) qui sent le dioxyde de soufre | ||||||
| Propriétés | |||||||
| Masse molaire | 222,33 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 2,34 g cm | ||||||
| Point de fusion | 190 °C (décomposition) | ||||||
| Point d'ébullition | Non applicable | ||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| LD50 | |||||||
| WGK | 1 (légèrement dangereux pour l'eau) | ||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Disulfite de potassium (K2 S2 O5 ) ou métabisulfite de potassium , Pyrosulfite de potassium appelé, est un sel de potassium de l'acide disulfureux, qui n'est pas stable sous forme libre. Les disulfites ont une liaison soufre-soufre assez longue et instable. Le disulfite de potassium est principalement utilisé comme conservateur (E 224) dans l'industrie alimentaire. Dans des conditions acides, le composé libère du dioxyde de soufre :
Obtenir et afficher
Il est produit par dimérisation thermique (condensation) de l'hydrogénosulfite de potassium avec élimination d'eau (1), ou par réaction de dioxyde de soufre et de sulfite de potassium dans de la potasse caustique (2) :
- (1)
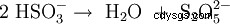
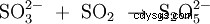
Utilisation
L'additif alimentaire disulfite de potassium (E 224) est utilisé comme conservateur, antioxydant et stabilisateur de couleur dans les aliments (par exemple également dans la sulfuration du vin).
Il est également couramment utilisé comme agent réducteur dans l'industrie chimique, pour blanchir le sucre, comme caustique dans l'industrie électronique et comme composant de fixateurs dans l'industrie photographique.
Références
- ↑ Hazardous-materials-data.de [1]
- ↑ inorganics.basf.com [2]
- ↑ Merck - ChemDAT.info [3]
- ↑ metallograf.de [4]