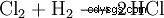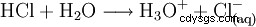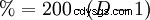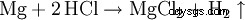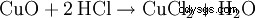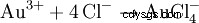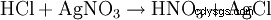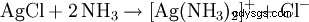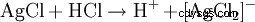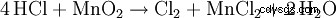| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| No hay fórmula estructural disponible | |||||||
| General | |||||||
| Nombre | Ácido clorhídrico | ||||||
| Otros nombres |
| ||||||
| Fórmula molecular | No aplicable | ||||||
| Número CAS | 7647-01-0 | ||||||
| Breve descripción | líquido de incoloro a amarillento con un olor acre | ||||||
| Propiedades | |||||||
| Masa molar | No aplicable | ||||||
| Estado de la materia | líquido | ||||||
| Densidad | 1,19 g cm (solución al 37 %) | ||||||
| Punto de fusión | −35 °C (solución al 36 %) | ||||||
| Punto de ebullición | 57 °C (solución al 36 %) | ||||||
| Presión de vapor | 127 hPa (20 °C, solución al 36 %) | ||||||
| Solubilidad | El cloruro de hidrógeno se puede disolver en agua hasta una concentración del 37% | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| MAC | 2 ml m o 3,0 mg m | ||||||
| WGK | 1 - ligeramente peligroso para el agua | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Ácido clorhídrico (nombre sistemático ácido clorhídrico ) es una solución acuosa del gas cloruro de hidrógeno (fórmula química HCl). Es un ácido inorgánico fuerte y es uno de los ácidos minerales. Las sales del ácido clorhídrico se llaman cloruros. El cloruro más conocido es el cloruro de sodio (NaCl, sal común).
Historia
El ácido clorhídrico debe haber sido conocido por los primeros alquimistas. Su descubrimiento se atribuye a Maria Prophetissa en el siglo I ya Geber en el siglo IX.
Ya en la primera mitad del siglo XV, Basilius Valentinus obtuvo ácido clorhídrico haciendo reaccionar halita (sal de roca) con vitriolo de hierro. Johann Rudolph Glauber logró producirlo a partir de sal de mesa y ácido sulfúrico en el siglo XVII. Lavoisier llamó al ácido clorhídrico acide muriatique (lat. muria =salmuera). Los manantiales salinos todavía se llaman manantiales muriáticos designado. En América del Norte, el ácido clorhídrico también se llama ácido muriático llamado.
Ocurrencias
En la naturaleza, el ácido clorhídrico se encuentra en gases volcánicos y en solución diluida en lagos de cráteres. Se encuentra en forma libre en el jugo gástrico de los vertebrados (0,1 a 0,5 por ciento en masa). Los depósitos de sales de ácido clorhídrico son casi inagotables, como sal gema y disueltas en agua de mar.
Obtención y visualización
El ácido clorhídrico se produce en el laboratorio a partir de ácido sulfúrico concentrado y sal común (de ahí el nombre):
El ácido sulfúrico desplaza el cloruro de hidrógeno de su sal, aunque el cloruro de hidrógeno es el ácido más fuerte. Esto es posible porque el cloruro de hidrógeno es gaseoso y prácticamente insoluble en ácido sulfúrico. Como resultado, el cloruro de hidrógeno desaparece constantemente del equilibrio. El sulfato resultante es hidrogenosulfato de sodio, una sal ácida.
En la industria química, el cloruro de hidrógeno de alta pureza se obtiene quemando gas detonante de cloro (una mezcla de hidrógeno y cloro).
Para completar el ácido, disuelva el gas de cloruro de hidrógeno en agua:
El ácido clorhídrico técnicamente puro es principalmente un subproducto de la cloración de compuestos orgánicos.
Propiedades
| % HCl | g HCl/l | Molaridad | Densidad |
|---|---|---|---|
| 10.5 | 110 | 3.06 | 1050 |
| 15,5 | 166 | 4.61 | 1075 |
| 20.4 | 224 | 6,22 | 1100 |
| 22,3 | 248 | 6,89 | 1110 |
| 24,3 | 272 | 7.56 | 1120 |
| 26,2 | 296 | 8,22 | 1130 |
| 28,2 | 321 | 8,92 | 1140 |
| 30,1 | 347 | 9,64 | 1150 |
| 32,1 | 372 | 10,23 | 1160 |
| 34,2 | 400 | 11,11 | 1170 |
| 36,2 | 428 | 11,89 | 1180 |
| 38,3 | 456 | 12,67 | 1190 |
| 40,4 | 485 | 13,47 | 1200 |
A 0 °C, el gas HCl se disuelve muy bien en agua (si el agua todavía está en fase líquida) (815 g o 507 l en un litro). Esto genera calor. A 25 °C, un litro de ácido clorhídrico saturado contiene 825 g de HCl (42,7%). La densidad de la solución es de 1,20 g cm. La dependencia de la concentración de la densidad se muestra en la tabla adyacente. Existe una conexión matemática aleatoria entre la densidad y el contenido porcentual de HCl:los decimales duplicados corresponden a la concentración, p. B. 1,10 g cm es la densidad del ácido clorhídrico al 20 %.
El ácido clorhídrico con un contenido de HCl de más del 36 por ciento en peso también se denomina ácido clorhídrico fumante se denota porque se forma una niebla blanca sobre los vasos abiertos.
El ácido clorhídrico puro se puede evaporar sin dejar residuos. Si se calienta ácido clorhídrico con un contenido de HCl superior al 20 % en peso, se escapa más HCl que agua, hasta quedar una mezcla de 20 % de HCl y 80 % de agua, lo que se conoce como azeótropo. El contenido exacto de HCl en el azeótropo a 1013 mbar es del 20,17 %, el punto de ebullición es de 110 °C.
El HCl se disocia completamente en agua, el ácido clorhídrico concentrado (32%) tiene un valor de pH de -1. En el aire húmedo, el gas HCl forma una niebla de finas gotas de ácido clorhídrico.
El ácido clorhídrico diluido es un buen conductor de electricidad.
Reacciones
El ácido clorhídrico disuelve la mayoría de los metales con la excepción de los metales preciosos como p. tantalio (germanio), cobre y mercurio (solo en presencia de oxígeno) y plata para formar cloruros e hidrógeno a menos que estén protegidos por pasivación.
Es muy adecuado para eliminar rápidamente el óxido del acero, ya que los óxidos metálicos reaccionan con el ácido clorhídrico para formar cloruros y agua:
Una mezcla de ácido clorhídrico y ácido nítrico se llama agua regia porque también puede disolver el oro, el "rey de los metales". Además del efecto oxidante del cloruro de nitrosilo y el cloro naciente, la reducción de la concentración efectiva de iones de oro a través de la formación de complejos también contribuye:
Uso
El ácido clorhídrico es de gran importancia en la industria química como ácido inorgánico. El ácido clorhídrico se utiliza, por ejemplo, en el procesamiento de minerales y fosfato de roca. Se utiliza en el tratamiento ácido de pozos de petróleo y gas y en el procesamiento de metales para decapado, grabado y soldadura.
El ácido clorhídrico es un reactivo importante en el análisis químico. Es capaz de separar un grupo de metales de otros metales por precipitación. Estos se pueden analizar más a fondo por separado (ver; grupo de ácido clorhídrico). La alcalimetría es otra área de uso del ácido clorhídrico.
Como aditivo alimentario, el ácido clorhídrico lleva la designación E 507.
Importancia biológica
En humanos y animales, el ácido clorhídrico es un componente del jugo gástrico, donde provoca, entre otras cosas, la hidrólisis de las grasas, pero también sirve para matar los gérmenes antes de que ingresen al sistema digestivo posterior.
Instrucciones de seguridad
El contacto con la piel provoca quemaduras químicas. Los vapores son irritantes En caso de contacto con los ojos, lávense inmediata y abundantemente con agua y acúdase a un médico. En caso de accidente o si no se siente bien, busque atención médica de inmediato.
Prueba
El ácido clorhídrico se detecta por un lado por su carácter ácido. Además, el anión cloruro se identifica en una solución muy diluida por precipitación con nitrato de plata en forma de cloruro de plata:
El precipitado blanco resultante se disuelve en agua amoniacal o en ácido clorhídrico concentrado con la formación de un complejo:
Si se calienta ácido clorhídrico en presencia de dióxido de manganeso, se produce cloro gaseoso:
El contenido porcentual de ácido clorhídrico se determina por valoración con sosa cáustica (→ acidimetría, análisis volumétrico). Esta determinación, así como la de cloruros, se puede realizar fotométricamente utilizando la sal de mercurio del ácido cloranílico. El contenido de ácido clorhídrico en el jugo gástrico se determina utilizando el reactivo de Günzburg.
Referencias
- ↑ Entrada sobre ácido clorhídrico en la base de datos de sustancias GESTIS de BGIA, consultada el 16 de diciembre de 2007 (se requiere JavaScript)
- ↑ Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman:Libro de texto de química inorgánica , 101ª edición, p.460f., Gruyter 1995, ISBN 978-3-11-012641-9