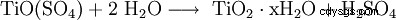| fórmula estructural | |||||||
|---|---|---|---|---|---|---|---|
| No hay fórmula estructural disponible | |||||||
| General | |||||||
| Nombre | Óxido de titanio (IV) | ||||||
| Otros nombres |
| ||||||
| Fórmula molecular | O2 Ti | ||||||
| Número CAS | 13463-67-7 | ||||||
| Breve descripción | polvo cristalino blanco | ||||||
| Propiedades | |||||||
| Masa molar | 79,90 g mol | ||||||
| Estado de la materia | arreglado | ||||||
| Densidad | 4,24 g·cm | ||||||
| Punto de fusión | 1855 °C | ||||||
| Punto de ebullición | 2900°C | ||||||
| Solubilidad | malo en ácido fluorhídrico, ácido nítrico y sulfúrico concentrado, insoluble en agua, ácido clorhídrico, ácido nítrico y sulfúrico diluido | ||||||
| Instrucciones de seguridad | |||||||
| |||||||
| Propiedades termodinámicas | |||||||
| ΔHf | −249 kJ/mol (rutilo) | ||||||
| Donde sea posible y común, se utilizan unidades SI. A menos que se indique lo contrario, los datos proporcionados se aplican en condiciones estándar. | |||||||
Óxido de titanio (IV) (dióxido de titanio ) es uno de los óxidos de titanio.
Ocurrencias
El óxido de titanio (IV) se presenta naturalmente en tres modificaciones:
- El rutilo es un mineral tetragonal de hábito mayoritariamente prismático. El nombre rutilo viene del latín rutilus – rojizo. El rutilo tiene una densidad de 4,26 g/cm. Es particularmente popular como pigmento blanco.
- Anatasa forma cristales holoédricos tetragonales (holoédrico significa el grupo más simétrico dentro de un sistema cristalino, en el tetragonal por lo tanto 4/m 2/m 2/m). La anatasa gradualmente (más rápidamente a partir de una temperatura superior a 700 °C) se transforma irreversiblemente en rutilo. La densidad de la anatasa es de 3,88 g/cm. Anatasa también sirve como pigmento blanco.
- La brookita forma minerales ortorrómbicos y no sirve como pigmento blanco. Brookite también se convierte en rutilo por debajo del punto de fusión.
Dado que los depósitos naturales tienen colores perturbadores que z. B. por hierro en ilmenita (FeTiO3 ), estos se refinan en el proceso de sulfato o proceso de cloruro (preferentemente).
Obtención y visualización
Por solvólisis (hidrólisis) del compuesto Ti(IV):
Propiedades
El punto de fusión del dióxido de titanio es de 1855 °C. Es térmicamente estable, duradero, tiene un alto índice de refracción (2,8) y por tanto un gran poder colorante y cubriente. El dióxido de titanio es químicamente muy inerte. Es resistente a la luz, económico, completamente no tóxico y, por lo tanto, el pigmento blanco más importante.
Uso
El dióxido de titanio se utiliza como colorante blanco. Fue descubierto en Noruega y EE. UU. en 1908 y fabricado allí a partir de 1909 con el nombre de Kronos Titanium White. La producción comenzó en Alemania en 1924 bajo el nombre de Degea-Titanweiß. El blanco de titanio solo se produjo en forma de anatasa hasta 1938, pero luego principalmente en forma de rutilo, que demostró ser más estable a los aglutinantes de aceite y colorantes orgánicos. Por lo tanto, también se lo denominó blanco de rutilo.
El blanco titanio tiene la mayor opacidad de todos los pigmentos blancos y una excelente capacidad aclarante. Es químicamente estable, no tóxico y se puede encontrar bajo la designación E 171 como aditivo alimentario en pasta de dientes y pastillas para la tos, por ejemplo. También se utiliza a veces en la pintura al óleo. En el campo técnico, se utiliza en pinturas y barnices (por ejemplo, para pintura de paredes y textiles), en papel y como bloqueador UV en cremas solares y abrillantadores en medicamentos (tabletas). El efecto fotocatalítico del TiO2 Las nanopartículas se utilizan en relación con la actividad UV para superficies de "autolimpieza" (autolimpieza fotocatalítica). La célula solar de colorante (célula de Grätzel) se basa de nuevo en las propiedades semiconductoras del dióxido de titanio. El dióxido de titanio también se utiliza como componente principal del dieléctrico cerámico en los condensadores cerámicos de Clase 1.
El dióxido de titanio en la modificación de anatasa es el componente principal de los catalizadores utilizados para la desnitrificación industrial de gases de combustión mediante el proceso SCR.
La producción de óxido de titanio mediante el proceso de sulfato produce ácido diluido (ácido sulfúrico diluido), parte del cual se reutiliza para la producción de óxido de titanio por concentración. En algunos países, parte de este ácido diluido todavía se vierte en ríos y mares o se vierte. El proceso de cloruro, por otro lado, no produce ningún ácido diluido. El cloro utilizado permanece en gran parte en el ciclo del proceso.
TiO2 también se utiliza en el campo del acabado de baldosas, lo que significa que las superficies de las baldosas tratadas se vuelven repelentes de la suciedad.
Prueba
El dióxido de titanio recién precipitado en frío es anfótero y soluble en ácidos minerales diluidos. La digestión se realiza con hidrogenosulfato de potasio en un crisol de porcelana. Luego se disuelve en agua fría con un poco de ácido sulfúrico. Con unas gotas de peróxido de hidrógeno, el amarillo (básico) a amarillo-naranja (ácido, foto) [Ti(O2 ) aq] El ácido clorhídrico y el zinc (gránulos) forman hidrógeno naciente, que transforma el Ti(IV) en rojo-violeta [Ti(H2 O)6 ] reducido.
Nanotecnología
Pruebas individuales
- ↑ Entrada sobre óxido de titanio (IV) en la base de datos de sustancias GESTIS de BGIA, consultada el 29 de noviembre de 2007 (se requiere JavaScript)
- ↑ Susanne Donner:Limpiar con el poder de la luz . Technology Review, No. 7, julio de 2006, págs. 19 y siguientes.