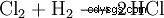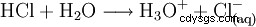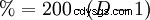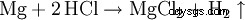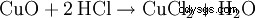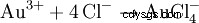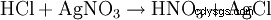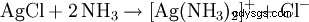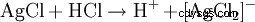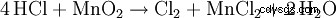| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Ingen strukturformel tillgänglig | |||||||
| Allmänt | |||||||
| Namn | Saltsyra | ||||||
| Andra namn |
| ||||||
| Molekylformel | Ej tillämpligt | ||||||
| CAS-nummer | 7647-01-0 | ||||||
| Kort beskrivning | färglös till gulaktig vätska med en stickande lukt | ||||||
| Egenskaper | |||||||
| Molarmassa | Ej tillämpligt | ||||||
| Sakens tillstånd | flytande | ||||||
| Densitet | 1,19 g cm (37 % lösning) | ||||||
| Smältpunkt | -35 °C (36 % lösning) | ||||||
| Kokpunkt | 57 °C (36 % lösning) | ||||||
| Ångtryck | 127 hPa (20 °C, 36 % lösning) | ||||||
| Löslighet | Klorväte kan lösas i vatten upp till en koncentration på 37 % | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | 2 ml m eller 3,0 mg m | ||||||
| WGK | 1 - något farligt för vatten | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Saltsyra (systematiskt namn saltsyra ) är en vattenlösning av gasen väteklorid (kemisk formel HCl). Det är en stark, oorganisk syra och är en av mineralsyrorna. Salterna av saltsyra kallas klorider. Den mest kända kloriden är natriumklorid (NaCl, vanligt salt).
Historik
Saltsyra måste ha varit känd för de första alkemisterna. Deras upptäckt tillskrivs Maria Prophetissa på 1000-talet och Geber på 800-talet.
Redan under första hälften av 1400-talet fick Basilius Valentinus saltsyra genom att reagera halit (stensalt) med järnvitriol. Johann Rudolph Glauber lyckades framställa den från bordssalt och svavelsyra på 1600-talet. Lavoisier kallas saltsyra acid muriatique (lat. muria =saltlake). Saltvattenkällor kallas fortfarande muriatiska källor utsedda. I Nordamerika kallas saltsyra även för muriatsyra ringde.
Förekomster
I naturen finns saltsyra i vulkaniska gaser och i utspädd lösning i kratersjöar. Det förekommer i fri form i magsaften hos ryggradsdjur (0,1 till 0,5 viktprocent). Avlagringarna av salter av saltsyra är nästan outtömliga, som stensalt och lösta i havsvatten.
Erhålla och visa
Saltsyra framställs i laboratoriet av koncentrerad svavelsyra och vanligt salt (därav namnet):
Svavelsyran tränger undan vätekloriden från dess salt, även om väteklorid är den starkare syran. Detta är möjligt eftersom väteklorid är gasformigt och praktiskt taget olösligt i svavelsyra. Som ett resultat försvinner väteklorid hela tiden från jämvikten. Det resulterande sulfatet är natriumvätesulfat, ett surt salt.
Inom den kemiska industrin erhålls väteklorid med hög renhet genom att bränna klordetonerande gas (en blandning av väte och klor).
För att fullborda syran, lös vätekloridgasen i vatten:
Tekniskt ren saltsyra är huvudsakligen en biprodukt av kloreringen av organiska föreningar.
Egenskaper
| % HCl | g HCl/l | Molaritet | Täthet |
|---|---|---|---|
| 10.5 | 110 | 3.06 | 1 050 |
| 15.5 | 166 | 4.61 | 1 075 |
| 20.4 | 224 | 6,22 | 1 100 |
| 22,3 | 248 | 6,89 | 1 110 |
| 24,3 | 272 | 7,56 | 1 120 |
| 26,2 | 296 | 8,22 | 1 130 |
| 28,2 | 321 | 8,92 | 1 140 |
| 30,1 | 347 | 9,64 | 1 150 |
| 32,1 | 372 | 10,23 | 1 160 |
| 34,2 | 400 | 11,11 | 1 170 |
| 36,2 | 428 | 11.89 | 1 180 |
| 38,3 | 456 | 12.67 | 1 190 |
| 40,4 | 485 | 13,47 | 1 200 |
Vid 0 °C löser sig HCl-gas mycket bra i vatten (om vattnet fortfarande är i flytande fas) (815 g eller 507 l i en liter). Detta skapar värme. Vid 25 °C innehåller en liter mättad saltsyra 825 g HCl (42,7%). Lösningens densitet är 1,20 g cm. Densitetens koncentrationsberoende visas i tabellen intill. Det finns ett slumpmässigt matematiskt samband mellan densiteten och den procentuella halten av HCl:de dubbla decimalerna motsvarar koncentrationen, t.ex. B. 1,10 g cm är densiteten för 20 % saltsyra.
Saltsyra med en HCl-halt på mer än 36 viktprocent kallas även rykande saltsyra betecknas för att en vit dimma bildas över öppna kärl.
Ren saltsyra kan förångas utan att lämna några rester. Om saltsyra med en HCl-halt på mer än 20 viktprocent värms upp kommer mer HCl än vatten ut, tills en blandning av 20 % HCl och 80 % vatten återstår, vilket är känt som en azeotrop. Det exakta innehållet av HCl i azeotropen vid 1013 mbar är 20,17 %, kokpunkten är 110 °C.
HCl dissocierar helt i vatten, koncentrerad saltsyra (32%) har ett pH-värde på -1. I fuktig luft bildar HCl-gas en dimma av fina droppar saltsyra.
Utspädd saltsyra är en bra ledare av elektricitet.
Reaktioner
Saltsyra löser de flesta metaller med undantag för ädelmetaller som t.ex. tantal (germanium), koppar och kvicksilver (endast i närvaro av syre) och silver för att bilda klorider och väte om de inte skyddas av passivering.
Den är mycket väl lämpad för att snabbt ta bort rost från stål, eftersom metalloxider reagerar med saltsyra och bildar klorider och vatten:
En blandning av saltsyra och salpetersyra kallas aqua regia eftersom den också kan lösa upp guld, "metallernas kung". Förutom den oxiderande effekten av nitrosylkloriden och det begynnande kloret bidrar även minskningen av den effektiva guldjonkoncentrationen genom komplexbildning:
Användning
Saltsyra är av stor betydelse i den kemiska industrin som en oorganisk syra. Saltsyra används till exempel vid bearbetning av malmer och bergfosfat. Det används vid syrabehandling av olje- och gaskällor och vid metallbearbetning för betning, etsning och lödning.
Saltsyra är ett viktigt reagens vid kemisk analys. Den kan separera en grupp metaller från andra metaller genom utfällning. Dessa kan sedan analyseras ytterligare separat (se; saltsyragrupp). Alkalimetri är ett annat användningsområde för saltsyra.
Som livsmedelstillsats bär saltsyra beteckningen E 507.
Biologisk betydelse
Hos människor och djur är saltsyra en komponent i magsaften, där den bland annat orsakar hydrolys av fetter, men även tjänar till att döda bakterier innan de kommer in i det vidare matsmältningssystemet.
Säkerhetsinstruktioner
Kontakt med huden orsakar kemiska brännskador. Ångorna är irriterande. Vid kontakt med ögonen, skölj genast med mycket vatten och sök läkare. I händelse av en olycka eller om du mår dåligt, kontakta omedelbart läkare.
Bevis
Saltsyra upptäcks å ena sidan genom sin sura karaktär. Dessutom identifieras kloridanjonen i en starkt utspädd lösning genom utfällning med silvernitrat i form av silverklorid:
Den resulterande vita fällningen löser sig i ammoniakvatten eller i koncentrerad saltsyra under bildandet av ett komplex:
Om saltsyra värms upp i närvaro av mangandioxid, bildas klorgas:
Den procentuella halten av saltsyra bestäms genom titrering med kaustiksoda (→ acidimetri, volymetrisk analys). Denna bestämning, liksom den av klorider, kan utföras fotometriskt med användning av kvicksilversaltet av kloranilsyra. Saltsyrahalten i magsaften bestäms med Günzburgs reagens.
Referenser
- ↑ Post om saltsyra i GESTIS-substansdatabasen för BGIA, hämtad den 16 december 2007 (JavaScript krävs)
- ↑ Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman:Textbook of Inorganic Chemistry , 101:a upplagan, s.460f., Gruyter 1995, ISBN 978-3-11-012641-9