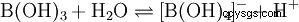| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allmänt | |||||||
| Namn | borsyra | ||||||
| Andra namn | Borofax | ||||||
| Molekylformel | H3 BO3 | ||||||
| CAS-nummer | 10043-35-3 | ||||||
| Kort beskrivning | vitt pulver | ||||||
| Egenskaper | |||||||
| Molarmassa | 61,83 g/mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 1,44 g/cm | ||||||
| Smältpunkt | Sönderdelas vid 185°C | ||||||
| Kokpunkt | finns inte | ||||||
| Ångtryck | 2,7 hPa (20 °C) | ||||||
| Löslighet | 50 g/l i vatten | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | inga | ||||||
| LD50 | 2660 mg/kg | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
borsyra (även:ortoborsyra ), H3 BO3 , är den enklaste syresyran av bor, dess salter kallas borater. (Tidigare även kallad borhydroxid)
Egenskaper
Ren borsyra bildar fjällande, färglösa, glänsande kristaller som har en smältpunkt på 171 °C. Det är initialt svårt att lösa upp i vatten, men denna process accelererar med ökande koncentration. Lösningen reagerar svagt surt. En flyktig borsyrametylester bildas med metanol – även utan koncentrerad svavelsyra – som brinner med en grön låga och används för kvalitativ bordetektering.
När ortoborsyran värms upp spjälkas vattnet och metaborsyran HBO2, som förekommer i flera modifieringar, bildas och slutligen, med ytterligare eliminering av vatten, dibortrioxid B2 O3 .
Trots sina tre väteatomer reagerar borsyra som en monoprotisk syra i vatten och ger tetrahydroxoboratjonen B(OH)4 . Här beter den sig inte som en Brønsted-syra som en protondonator, utan som en Lewis-syra som en hydroxidacceptor:
Borsyra är en mycket svag syra (pKs =9,25). Genom reaktion med flervärda alkoholer såsom. B. mannitol, kan syrastyrkan ökas avsevärt. Detta beror på en förskjutning av jämvikten åt höger mot ett tetraoxoboratderivat som ett resultat av förestring:
Denna reaktion används för alkalimetrisk titrering av borsyra och används även vid Kjeldahls bestämning av kväve.Den är inte giftig i små mängder. men boraner är mycket giftiga.
Förekomst och extraktion
Fri borsyra finns i ångkällorna (fumaroler) i centrala Italien i Toscana. Syran kan erhållas från dessa källor genom att förånga den i glänsande blodplättar. Borsyra förekommer även i Toscana som mineralet sassolin. Alkali- och jordalkalisalter, såsom mineralet kernit Na2, är dock av stor betydelse B4 O7 · 4H2 O. Ett liknande, sällsyntare mineral är borax, som innehåller 8 eller 10 ekvivalenter kristallvatten. Numera erhålls detta dock huvudsakligen från kernit. Genom att behandla borax med saltsyra eller svavelsyra kan borsyran B(OH)3 släpp.
Användning
Vattenlösningen ("borrvatten") fungerar som ett milt desinfektionsmedel och är även godkänt som konserveringsmedel E284. Borsyra är en mellanprodukt som används vid tillverkning av borosilikatglas, porslin, emalj och finns även i flamskyddsmedel och betningsmedel. Den årliga världsproduktionen av borsyra är över 200 kiloton.
En annan användning av borsyra är i kärnkraftverk med tryckvattenreaktorer. Där används borsyra på grund av den höga absorptionskoefficienten för termiska neutroner av isotopen B-10, som finns i naturligt bor till 20 procent, för att kontrollera multiplikationsfaktorn k och därmed reaktorns effekt.
Dessutom används borsyran för att beräkna CO2 -Lön som användes på jorden i forna tider. I en sur miljö införlivas mer bor i borsyra. När pH ändras till alkaliskt omvandlas borsyran till borat, saltet av borsyra. Eftersom foraminifera (fossila såväl som nyare encelliga organismer) behöver borat för att bygga upp sitt skal, kan förhållandet användas för att bestämma vilket pH som fanns i detta område vid vilken tidpunkt i jordens historia. Eftersom skalen från sådana protozoer samt musslor etc. utgör huvuddelen av det marina sedimentet kan sedimentkärnor helt enkelt tas därifrån och undersökas i laboratoriet för de två borisotoperna. Sådana resultat korrelerade väl med luftbubblorna fångade i iskärnor.
Borsyra i kombination med metanol ger en grön flamfärg; i samband med andra alkanoler en grön lågakant. Den här egenskapen används mycket i eldshower, till exempel för att färga flamstickor, pois eller eldskålar.
Källor
- ↑ Materialsäkerhetsdatablad (Merck)