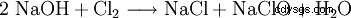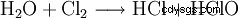| strukturformel | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Allmänt | ||||||||
| Namn | Natriumhypoklorit | |||||||
| Andra namn | natriumhypoklorit, natriumhypoklorit, natriumhypoklorit, L'eau de Labarraque/Eau de Javel (vattenlösning) | |||||||
| Molekylformel | NaOCl | |||||||
| CAS-nummer | 7681-52-9 | |||||||
| Kort beskrivning | gul fast substans med en obehaglig, söt lukt | |||||||
| Egenskaper | ||||||||
| Molarmassa | 74,44 g mol | |||||||
| Sakens tillstånd | fixat | |||||||
| Densitet | 1,2 g cm (13 % fri klorlösning) | |||||||
| Smältpunkt | 24,5 °C (pentahydrat) | |||||||
| Ångtryck | 23 hPa (20 °C) | |||||||
| Löslighet | bra i vatten (293 g/L vid 0 °C, 942 g/L vid 23 °C, varje pentahydrat) | |||||||
| Säkerhetsinstruktioner | ||||||||
| ||||||||
| WGK | 2 – farligt för vatten | |||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | ||||||||
Natriumhypoklorit (NaOCl) är natriumsaltet av hypoklorsyra (även känd som hypoklorsyra) (HClO) Det är ett vitt pulver som normalt innehåller sex mol kristallvatten per mol natriumhypoklorit. Det vanliga namnet på vattenlösningen av natriumhypoklorit är Eau de Labarraque eller Eau de Javel , där etiketten Eau de Javel är strängt felaktigt. Detta avser en lösning av kaliumhypoklorit, möjligen i blandning med andra salter såsom kaliumklorid; men det är ofta inte särskiljt.
Erhållande/representation
Natriumhypoklorit framställs genom att tillföra klorgas i kaustiksoda eller genom att elektrolysera en natriumkloridlösning.
Denna reaktion orsakar betydande tekniska problem. Eftersom det formellt är en hydrolys av klor enligt
med efterföljande neutralisering av den resulterande saltsyran eller underklorsyran, är det lätt att se att reaktionsentalpierna för dessa reaktioner leder till stark upphettning, för vilken alla hypokloriter är känsliga. Faktum är att samma kemiska process används för att göra klorat, men genom att reagera det i het lösning. Av denna anledning innehåller alla tekniska hypokloriter varierande, ibland stora, mängder klorat. Reaktionen av hypoklorit som produceras under produktionen med klor leder slutligen till klorat.
Användning
Syftet med användningen är blekning eller desinficering (t.ex. i simbassänger). Användning i simbassänger är inte oproblematisk, eftersom mängderna som ska doseras måste vara tillräckliga för att klorera ammoniaken (eller aminerna) utöver monokloraminnivån, eftersom en tillräcklig desinfektion är garanterad först då.
Natriumhypoklorit är också den huvudsakliga aktiva ingrediensen i desinficering och blekning av hushållsrengöringsmedel som DanKlorix och många andra. Olika mögelborttagningsmedel innehåller också denna aktiva ingrediens.
Natriumhypoklorit används också inom tandvården. Det används till exempel vid rotbehandling av bakteriellt infekterade tänder för att desinficera dem.
Säkerhetsinstruktioner
Extrem försiktighet krävs vid hantering av natriumhypoklorit! Det finns risk för explosion när natriumhypoklorit reagerar med många ämnen och grupper av ämnen, inklusive reduktionsmedel, aminer, myrsyra, metanol, organiska ämnen och några andra. Angriper kraftigt slemhinnorna vid inandning.
Dessutom reagerar natriumhypoklorit med syror (t.ex. saltsyra, salpetersyra) och oxidationsmedel (t.ex. väteperoxid, permanganat) ibland mycket häftigt, genererar värme och frigör klorgas och/eller nitrösa gaser.
Enbart värme eller solljus kan göra att natriumhypoklorit sönderfaller och bland annat frigör klor, väteklorid, klordioxid och syre. Detta måste också beaktas vid förvaring av ämnet.
Källor
- ↑ BGIA GESTIS ämnesdatabas:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 12 maj. 2007