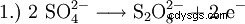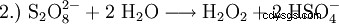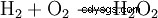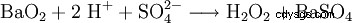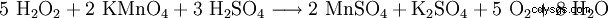| strukturformel | ||||||||
|---|---|---|---|---|---|---|---|---|
| Allmänt | ||||||||
| Namn | Väteperoxid | |||||||
| Andra namn | μ-1κO,2κO'-dioxiddiväte, perhydrol, väteperoxid (föråldrad) | |||||||
| Molekylformel | H2 O2 | |||||||
| CAS-nummer | 7722-84-1 (vattenlösning) | |||||||
| Kort beskrivning | färglös vätska | |||||||
| Egenskaper | ||||||||
| Molarmassa | 34,02 g mol | |||||||
| Sakens tillstånd | flytande | |||||||
| Densitet | 1,45 g cm (20 °C, ren) 1,11 g cm (20 °C, 30 %) | |||||||
| Smältpunkt | −0,41 °C (ren) −33 °C (35 %) −11 °C (90 %) | |||||||
| Kokpunkt | 150,2 °C (ren) 108 °C (35 %) 142 °C (90 %, med sönderdelning) | |||||||
| Ångtryck | 1,9 hPa (20°C) | |||||||
| Löslighet | helt blandbar med vatten | |||||||
| Säkerhetsinstruktioner | ||||||||
| ||||||||
| MAK | 0,5 ml m eller 0,71 mg m | |||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | ||||||||
Väteperoxid (H2 O2 ) är en ljusblå, i stort sett stabil flytande förening av väte och syre, färglös i utspädd form. Det är något mer trögflytande än vatten, en svag syra och ett mycket starkt oxidationsmedel till de flesta ämnen, som i och för sig reagerar häftigt med ämnen som t.ex. B. koppar, mässing, kaliumjodid reagerar och fungerar därmed som ett starkt blekmedel och desinfektionsmedel. I en mycket koncentrerad form kan den användas både som en enkel och som en komponent raketdrivmedel.
Fysikaliska egenskaper
H2 O2 -Molekylen är böjd (dihedrisk vinkel =111°). Ren väteperoxid är mycket trögflytande på grund av den starka tvärbindningen genom vätebindningar. Eftersom högkoncentrerad (=nästan vattenfri) H2 O2 instabilt och spontant sönderfaller till en explosion, speciellt när det kommer i kontakt med metaller, säljs det normalt receptfritt som en maximal lösning på 35 % i vatten. För industriella behov finns det dock även koncentrationer på 50 % H2 O2 i vatten.
Kontakt med mer än 20 % väteperoxidlösning kan orsaka kemiska brännskador. Skyddshandskar måste därför bäras vid hantering.
Tillverkning
Förr framställdes väteperoxid huvudsakligen genom elektrolys av svavelsyra. Detta bildar peroxodisvavelsyra, som sedan hydrolyseras tillbaka till svavelsyra och väteperoxid.
Idag tillverkas väteperoxid tekniskt med antrakinonprocessen. För detta ändamål reageras antrahydrokinon med atmosfäriskt syre under tryck för att bilda väteperoxid och antrakinon. I nästa steg kan antrakinon reduceras igen med väte till antrahydrokinon etc. Bruttoekvationen är:
I laboratorieskala produceras även väteperoxid vid behandling av peroxider med syror. Ett historiskt viktigt reagens är bariumperoxid, som reagerar i en svavelsyralösning för att bilda väteperoxid och bariumsulfat.
Molära entalpier för bildning är:
- Δf Hgas :-136,11 kJ/mol
- Δf Hliq :-188 kJ/mol
- Δf Hsol :-200 kJ/mol
Kemiska egenskaper
Väteperoxid tenderar att bryta ner till vatten och syre. Detta frigör energi på 98,02 kJ/mol:
-
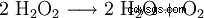
- Oproportionering av två molekyler väteperoxid till vatten och syre.
Denna nedbrytningsreaktion katalyseras av bland annat Mn (se bevis) eller andra tungmetalljoner, I- och OH-joner. Därför H2 O2 - Kommersiellt tillgängliga lösningar blandas med stabilisatorer (inklusive fosforsyra). Det är ett starkt oxidationsmedel. När oxidationstillståndet reduceras från −I till −II bildas endast vatten och syre som reaktionsprodukter. Det finns inga biprodukter som är svåra att separera eller störande, vilket förenklar användningen i laboratoriet.
Det kan också fungera som ett reduktionsmedel mot starkare oxidationsmedel (t.ex. kaliumpermanganat).
Väteperoxid är en mycket svag syra; dess oorganiska salter och organiska estrar är hydroperoxider och peroxider.
Bevis
För kvalitativ detektion, Mn-joner (t.ex. MnSO4 ) erkände. Om gas utvecklas används glödspåntestet för att kontrollera syre. Om detta visar sig vara positivt, genom att det glödande chipet lyser, var H2 O2 närvarande.
- Detektion som kromperoxid (CrO(O2 )2 )
Gör från festivalrepetitionen. Kromtrioxid CrO3 med väteperoxid i det starkt sura området (pH <0) resulterar i den intensivt blåfärgade kromperoxiden, som löses i eter. För att göra detta, kaliumdikromat med utspädd H2 SO4 surgör och täck med 1 cm eter (avdrag!), tillsätt provet och skaka. Eterfasen blir blåaktig.
- Detektion som peroxotitanyl(IV)jon ([Ti(O2 )OH])
Detektionen med "titangul" (inte att förväxla med ett färgämne med samma namn) är mycket känsligt. (Färglösa) titan(IV)joner, även med spår av väteperoxid, resulterar i den intensivt orangegulfärgade peroxotitanyljonen. Omvänt kan ett ämne därför även testas för titan(IV) med väteperoxid.
- Detektion med kaliumpermanganat
För att bestämma koncentrationen i vattenlösningar, t.ex. B. blekbad.. Bestämningen utförs oximetriskt med n/10 kaliumpermanganatlösning i svavelsyralösning (byte till permanent ljusrosa färg (varar ca 1 min.) enligt följande ekvation:
Fysiologi
Väteperoxid är mycket frätande, särskilt som ånga. Om du får väteperoxid på huden bör du skölja området väl med vatten (utspädning), eller åtminstone ta bort det från huden omedelbart. Det dödar snabbt hudcellerna, som sedan blir vita.
I allmänhet har väteperoxid en cytotoxisk effekt och har, på grund av sin starka toxicitet för många prokaryota mikroorganismer, en desinficerande effekt.
Väteperoxid bildas i många biokemiska processer. I den biologiska cykeln bildas den genom den oxidativa metabolismen av socker. Organismen skyddar sig mot dess toxiska effekter med hjälp av enzymer - katalaser, peroxidaser - som omvandlar den tillbaka till giftfri O2 och H2 Bryt ner O.
Efter befruktning av en spermie producerar den kvinnliga äggcellen kortvarigt låga koncentrationer av väteperoxid för att döda andra spermier.
Dessutom är väteperoxid en signalmolekyl för att inducera växtens försvar mot patogener (aspekt av cytotoxicitet).
Användning
Blekmedel
Väteperoxid är ett blekmedel, så det används i kosmetika för att bleka hår och bleka tänder. Det används ofta som en peroxid bunden till karbamid.
- Platinablond, det maximala undvikandet av färg i håret, människan är skyldig till väteperoxid. Den extremt reaktiva vätskan förstör färgpigmenten i håret.
Världen över kan den största tillämpningen ses inom miljövänlig blekning av massa. Massa erhålls från trä och ligninet som det innehåller med H2 O2 blekt. Den huvudsakliga användningen av massa är vid tillverkning av papper, servetter, näsdukar etc.
Inom hantverk används väteperoxid för att bleka - d.v.s. för att ljusa - trä, t.ex. B. under restaurering eller renovering.
Väteperoxid eller blekmedel som innehåller väteperoxid, såsom en blandning av peroxiättiksyra och väteperoxid, används också i reklam med det konstgjorda ordet aktivt syre ringde.
Desinfektion och sterilisering
För desinfektion används väteperoxid som treprocentig lösning i mun och svalg, t.ex. B. i tandvård; det används också för att desinficera kontaktlinser i kontaktlinsrengörare och för att sterilisera förpackningsmaterial, samt för att desinficera händer. Det används också i ansiktskrämer för att öppna porer och bekämpa finnar och fläckar. Det används ofta för att rengöra industriavloppsvatten och för att desinficera vattnet i simbassänger.
Inom livsmedelsindustrin används 30 % väteperoxid i aseptiska påfyllningssystem för att sterilisera PET-flaskor Många livsmedel (drycker, mjölk, mejeriprodukter, såser, soppor, etc.) packas aseptiskt i kartonger, koppar, flaskor och folier för att förbättra hållbarhet och produktkvalitet. Den mest använda processen är baserad på sterilisering med koncentrerad väteperoxid (35%). Den höga bakteriedödande effekten av H2 O2 , miljökompatibiliteten och den goda tekniska genomförbarheten är skälen till den utbredda användningen av denna process. I operativ praxis görs en skillnad mellan spray- och doppbadsprocessen.
Syretillförsel
Väteperoxid kan användas i akvarier för att tillföra syre. Syret genereras i en oxidator. För att göra detta delas väteperoxid i vatten och syreradikaler i ett kärl i akvariet med hjälp av en katalysator.
Användning av flera effekter samtidigt
Vid renovering av interiörer kan väteperoxid användas för att motverka mögeltillväxt. Som desinfektionsmedel kan det både döda de biologiskt aktiva cellerna (fungicid) och förstöra sporerna (sporicid). Den kan inte användas som blekmedel Avlägsnade rester av beläggningen - på en vit porös yta - "optiskt ofarlig". Väteperoxid är att föredra framför alkohol eller natriumhypoklorit eftersom dessa ämnen är biprodukter som t.ex B. salter i undergrunden kan producera. Alkohol är varken spordödande eller blekande jämfört med väteperoxid.
Väteperoxid används också för blekning och desinficering vid beredning av ben. Inom tandvård, H2 O2 används för lokal desinfektion av tandvävnad och för att stoppa blödningar vid mindre ingrepp.
Inom jordbruket används väteperoxid för att desinficera växthus och för att syresätta hydroponiska odlingsmedier.
Biologi
För att bestämma bakteriekulturer utförs katalastestet med en 3% väteperoxidlösning. De flesta aeroba och fakultativt anaeroba bakterier, samt svampar, har enzymet katalas, som kan bryta ner H2, som är giftigt för celler O2 att dela.
Väteperoxid kan användas inom kriminalteknik för att upptäcka blod. 1818 upptäckte Louis Jacques Thenard att peroxidaset i hemoglobin bryter ner väteperoxid. Christian Friedrich Schönbein utvecklade ett blodprov från detta 1863. Idag används dock det känsligare Kastle-Meyer-testet för att upptäcka blod.
Experimentellt används väteperoxid inom biologin för att inducera programmerad celldöd i isolerade eukaryota celler.
Kaustik
Inom mikroelektronik används blandningen av svavelsyra och väteperoxid – kallad "piranha" – för att rengöra ytan på wafers och för att producera ett tunt, cirka 3–4 nm tjockt, hydrofilt oxidskikt på wafers. Nuförtiden är termen "SPM" (Sulphuric Peroxide Mixture) vanligare. Huvudapplikationen är borttagning av fotoresister.
Vid tillverkning av tryckta kretskort (PCB) används kopparkloridetsbad för att avlägsna koppar:
-
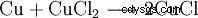 .
. - Elementär koppar reagerar med koppar(II)klorid och bildar koppar(I)klorid. Detta är en proportionering.
Väteperoxid används tillsammans med saltsyra för att regenerera kopparkloridetsningsbaden:
-
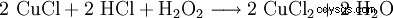 .
. - Koppar(II)kloriden regenereras genom att koppar(I)kloriden omsätts med väteperoxid och saltsyra. Kopparatomen oxideras.
Tillsatsen av väteperoxid och saltsyra styrs via redoxpotentialen.
Raket-/torpedmotorer
Som leverantör av energi och syre (nedbrytning via till exempel mangandioxid) användes den i koncentrerad form i raketdrift (t.ex.:Max Valier, Messerschmitt Me 163) och ubåtsdrift (Walter U-Boot). Väteperoxid, nedbruten med hjälp av kaliumpermanganat, användes också som drivmedel för bränslepumparna (500 hk) i A4:an. Onedbruten väteperoxid användes som syrebärare, flytande vid normal temperatur, i brittiska raketer (t.ex. Black Arrow) och brändes där med fotogen.
Väteperoxid tenderar att sönderdela okontrollerat. Så dog den 16 juli 1934 Dr. Kurt Wahmke och två tekniker i Kummersdorf vid explosionen av en motor som drivs av väteperoxid. På grund av faran vid användning och hantering (frätande effekt, okontrollerad sönderdelning, explosion om tank och rörsystem är förorenade) är användningen nu begränsad till små raketmotorer (rekordförsök, styrmotorer).
Förlisningen av den ryska atomubåten Kursk år 2000 ryktades vara orsakad av väteperoxid som läckte från en tank i en torped och sedan reagerade med koppardelar, vilket fick torpeden att spricka.
Tillverkning av sprängämnen
I närvaro av en lämplig katalysator reagerar väteperoxid med aceton för att bilda acetonperoxid. Acetonperoxid är ett sprängämne men används inte kommersiellt eftersom det är mycket osäkert att hantera. Närmare bestämt kallas acetonperoxid även för triacetontriperoxid, förkortat TATP. Andra sprängämnen gjorda med väteperoxid inkluderar hexametylentriperoxiddiamin (HMTD).
Enligt experter vid Fraunhofer Institute for Chemical Technology används TATP i de flesta självmordsbombningar i Israel. Attackerna den 7 juli 2005 mot Londons tunnelbana (55 döda) ska också ha utförts med TATP. Slutligen, den 4 september 2007, arresterades tre islamister utbildade i Pakistan i Oberschledorn, Sauerland, som ville producera TATP från 730 kg av en 35 % väteperoxidlösning för att attackera amerikanska anläggningar och restauranger i Tyskland som besöks av amerikanska medborgare.
Å andra sidan vet experter inte i detalj hur terrorister kunde detonera TATP gjord med väteperoxid på ett kontrollerat sätt. I synnerhet, i ett motverkat försök att smuggla flytande sprängämnen till ett flygplan i London 2007, ifrågasattes det om lämplig acetonperoxid kunde tillverkas ombord med hjälp av smugglade flaskor med väteperoxid och aceton.
Referenser
- Werner R. Thiel:Nya vägar till väteperoxid:alternativ till etablerade processer? Angewandte Chemie 111(21), sid. 3349-3351 (1999)
- Heribert Offermanns, Gunther Dittrich, Norbert Steiner:Väteperoxid i miljöskydd och syntes . Kemi i vår tid 34(3), s. 150–159 (2000), ISSN 0009-2851
Referenser
- ↑ Post om väteperoxid i ämnesdatabasen GESTIS för BGIA, hämtad 2007-11-16 (JavaScript krävs)
- ↑ Süddeutsche Zeitung den 6 september 2007, s. 2:"Current encyclopedia:väteperoxid ". Signerad:mkf
- ↑ Informationen i detta stycke är baserad på mkf signerad artikel "Aktuellt uppslagsverk:väteperoxid “ på sidan 2 i Süddeutsche Zeitung från 6.9.2007.
- ↑ Süddeutsche Zeitung av 6 september 2007, s. 1f.
- ↑ netzeitung.de
- ↑ Rundschau-online.de
- ↑ Det här stycket hänvisar till orakelsyndikat - Karl Weiss och Wikipedia-artikeln Acetonperoxid.