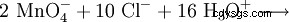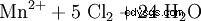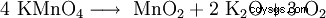| strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Allmänt | |||||||||
| Namn | Kaliumpermanganat | ||||||||
| Andra namn | Kaliumtetraoxomanganat(VII), kaliummanganat(VII), kaliumpermanganat(um) | ||||||||
| Molekylformel | KMnO4 | ||||||||
| CAS-nummer | 7722-64-7 | ||||||||
| Kort beskrivning | mörkvioletta kristaller med metallglans | ||||||||
| Egenskaper | |||||||||
| Molarmassa | 158,03 g mol | ||||||||
| Sakens tillstånd | fixat | ||||||||
| Densitet | 2,70 g cm | ||||||||
| Smältpunkt | Nedbrytning över 240 °C | ||||||||
| Kokpunkt | Ej tillämpligt | ||||||||
| Ångtryck | 0,01 mbar (vid 20 °C) | ||||||||
| Löslighet | måttlig i vatten (64 g/L vid 20 °C) | ||||||||
| Säkerhetsinstruktioner | |||||||||
| |||||||||
| MAK | 0,5 mg m | ||||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||||
Kaliumpermanganat (KMnO4 ) är kaliumsaltet av permangansyra, HMnO4, som är okänt i fritt tillstånd . Det är ett djupt röd-violett metallglans kristallint fast ämne och ett starkt oxidationsmedel. Permanganatanjonen är ensam ansvarig för saltets intensiva färg. Det beror på bildandet av ett laddningsöverföringskomplex. I permanganater är mangan i sitt högsta oxidationstillstånd, VII.
Egenskaper
Kaliumpermanganat bildar mörkrödvioletta glänsande kristaller som är måttligt lösliga i vatten och producerar en intensivt violett lösning även i låga koncentrationer. När de värms upp smälter kristallerna inte, utan sönderfaller med ett märkbart sprakande ljud, vilket frigör syre. Kristallint kaliumpermanganat är stabilt vid rumstemperatur, men dess vattenlösningar bryts ned med tiden.
Eftersom mangan är närvarande i sitt högsta oxidationstillstånd i permanganatanjonen förekommer det som ett mycket starkt oxidationsmedel i redoxreaktioner. Till exempel oxiderar kaliumpermanganat saltsyra till klorgas (laboratoriemetod för framställning av klor):
Dessutom oxiderar den till exempel sulfiter till sulfater, Fe(II) till Fe(III)-joner, alkoholer till karboxylsyror. Det kan också orsaka nedbrytning av [[organisk kemi|organiska] ämnen. Kaliumpermanganat är oxiderande.
Kaliumpermanganat sönderdelas från 240 °C till mangandioxid (MnO2 ), kaliumoxid (K2 O) och syre (O2 ):
Som ett komplex med kronetrar kan kaliumpermanganat även göras tillgängligt i opolära organiska lösningsmedel som bensen eller toluen, som utnyttjas i syntetisk organisk kemi.
Tillverkning
Den tekniska produktionen utgår från mangandioxid MnO2 med kaliumhydroxid och atmosfäriskt syre för att bilda det grönfärgade kaliummanganatet(VI) K2 MnO4 reagerade. Detta bearbetas vidare elektrokemiskt för att bilda kaliumpermanganat (anodisk oxidation) och säljs i kristallin form.
Användning
På grund av sin starka oxiderande effekt används kaliumpermanganat bland annat som desinfektionsmedel, deodorant och algicid. Vid kvantitativ kemisk analys (oxidimetri, manganometri, en redoxtitrering) används den för att bestämma ett stort antal ämnen (t.ex. järn, nitrit, oxalat och indirekt även kalcium); här indikeras slutpunkten för bestämningen av den violetta färgen. I laboratoriet används även alkalisk kaliumpermanganatlösning för att rengöra glas. Inom fotografering används det för att detektera fixeringssalt (natriumtiosulfat) och för att minska överexponerade bilder; detta oxiderar silvret.
När glycerin tappas på ett överskott av salt, antänds blandningen efter några sekunder till minuter och brinner med en karakteristisk violet låga. Denna fördröjda reaktion användes för att starta termitreaktioner på grund av den intensiva värmen.
Medicin
Inom medicinen används kaliumpermanganatlösning som sammandragning och desinfektionsmedel för yttre behandling av huden, t.ex. för fotsvamp eller blöjutslag (ATC-kod D08AX06). I Emergency Toxicology, burgundy Kaliumpermanganatlösning (ca 0,1%) används för magsköljning vid förgiftning efter intag av oxiderbara gifter.
Historisk
Tidigare fotografer använde kaliumpermanganat som en komponent i blixtpulver. Kaliumpermanganat användes för att gurgla halsont och i matlagningen för att deodorisera gammalt kött och göra det ätbart igen.
Säkerhetsinstruktioner
Kaliumpermanganat har vattenfarlighetsklass 3 (mycket farligt för vatten), som förutom sin oxiderande effekt måste beaktas vid omhändertagande av permanganatrester. Kaliumpermanganat har låg akut toxicitet (LD50). (råtta, oral) =750 mg/kg), men har en uttalat irriterande effekt på levande vävnad på grund av sin starkt oxiderande effekt, så att kemiska brännskador lätt uppstår. All kontakt annan än medicinsk användning eller till och med oralt intag måste därför förhindras! Permanganatdamm orsakar grumling av hornhinnan.
Den missfärgning av själva huden, som uppstår vid kontakt, är dock ofarlig och orsakas av den mangandioxid som bildas vid reduktionen av permanganat. Större missfärgade ytor kan blekas igen med sulfitlösningar.
Som ett resultat av sin starka oxiderande effekt reagerar kaliumpermanganat häftigt med många reducerande eller brännbara ämnen och självantändning kan uppstå. Blandningar med sådana ämnen som inte leder till en spontan reaktion är extremt brandfarliga och kan då reagera explosivt.
Källor
- ↑ Post för CAS-nr. 6487-48-5 i ämnesdatabasen GESTIS för BGIA, hämtad den 15 december 2007 (JavaScript krävs)
- ↑ Roth, Daunderer, Kormann:Toxic plants - plant toxins, ecomed Landsberg, 1988, ISBN 3-609-64810-4 , s. 810ff