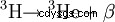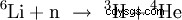| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Namn, symbol, Ordnungszahl | Helium, He, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Edelgase | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupp, Periode, Block | 18, 1, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | Farbloses Gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 4 · 10 % | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 4,002602 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 128 (31) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radie | 32.00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | 1s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen för energinivå | 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 2372,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 5250,5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikalisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 0,1785 kg·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetism | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | - K (−272,2 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 4,22 K (−268,93 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 22,4 · 10 m/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 0,0845 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzvärme | 0,021 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | - Pa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 972 m/s vid 273,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 5193 J/(kg · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 0 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,152 W/(m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxid (Basizität) | keine (keine) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 5,2 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gefahrstoffkennzeichnung | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R- och S-Sätze | R:keine R-Sätze | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S:9-23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich and gebräuchlich, were SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Helium (von griechisch ἥλιος hélios „Sonne“) är en farbloses, geruchloses, geschmackloses, ofoxiska kemiska element. Helium gehört zur Gruppe der Edelgase, seine Ordnungszahl ist 2, sein Elementsymbol He. Helium bleibt bis zu sehr tiefen Temperaturen gasförmig, erst nahe dem absoluten Nullpunkt wird es flüssig. Es ist die einzige Substanz, die bei Normaldruck selbst am absoluten Nullpunkt (0 K bzw. −273,15 °C) nicht fest wird. Helium är ämnet med de größten kända kemiska reaktionerna. Auch unter Extrembedingungen konnten bis jetzt keine Verbindungen des Heliums nachgewiesen werden, die nicht sofort nach der Bildung zerfallen. Helium kommt, soweit bekannt, nur atomar vor. Nur unter Extrembedingungen sind andere Formen denkbar. Das häufigste stabile Isotop ist He; ein weiteres stabiles Isotop ist das sehr seltene He.
Das Verhalten der beiden flüssigen Phasen „Helium-I“ och „Helium-II“ (insbesondere das Phänomen der Suprafluidität) von He ist Gegenstand aktueller Forschungen auf dem Gebiet der Quantenmechanik. Weiterhin ist flüssiges Helium ein unverzichtbares Hilfsmittel zur Erzielung der tiefsten Temperaturen, die zur Untersuchung von Eigenschaften wie zum Beispiel der Supraleitung von Materie bei Temperaturen nahe dem absoluten Nullpunkt erforderlich sind.
Helium ist, nach Wasserstoff, das zweithäufigste Element im Universum. Der größte Teil davon entstand in den ersten 3 Minuten nach dem Urknall. Der Rest ist Produkt der Kernfusion von Wasserstoff i Sternen. Auf der Erde wird He in Form von Alphateilchen vid dem Alphazerfall verschiedener radioaktiver Elemente wie zum Beispiel Uran oder Radium gebildet. Helium entsteht daraus, wenn das Alphateilchen anderen Atomen zwei Elektronen entreißt. Das so entstandene Helium sammelt sich in natürlichen Erdgas-Vorkommen in Konzentrationen bis zu sieben Volumenprozent. Daher kan Helium durch Fraktionierte Destillation aus Erdgas gewonnen.
Erste Hinweise auf Helium wurden 1868 durch den französischen Astronomen Pierre Janssen bei Untersuchungen des Lichtspektrums der Chromosphäre der Sonne entdeckt, wobei er die bis dahin unbekannte gelbe Spektrallinie von Helium fand.
Helium findet Anwendungen in der Tieftemperaturtechnik, in Tiefsee-Atemgeräten, as Kühlmittel für supraleitende Magneten, bei der Altersbestimmung von Gesteinen, as Füllgas für Luftballons und Luftschiffe und als Schutzgas für verschiedene industrielle Anwendungen (zum Beispiel beim Metallschutzgasschweißen von Silence-Werstellung bei Sil ). Nach dem Einatmen von Helium verändert sich aufgrund der im Vergleich zu Luft höheren Schallgeschwindigkeit kurzzeitig die Stimme („Micky-Maus-Stimme ").
Historik
Hinweise auf das Element Helium erhielt man zum ersten Mal aufgrund einer hellen gelben Spektrallinie bei einer Wellenlänge von 587,49 Nanometern im Spektrum der Chromosphäre der Sonne. Diese Beobachtung makte den französische astronomen Pierre Janssen under sin totala Sonnenfinsternis i Indien den 18 augusti 1868. Som en del av den kända kraften, önskade jag att ingen ska vara glauben. Erde geführt were coulde. Am 20. Oktober desselben Jahres bestätigte der Engländer Norman Lockyer, dass die gelbe Linie tatsächlich im Sonnenspektrum vorhanden ist und schloss daraus, that sie von einem bislang unbekannten Element verursacht wurde. Weil diese Spektrallinie nahe an der so genannten Fraunhofer D-Linie lag, nannte er die Linie D3, um sie von den nahe liegenden D1- und D2-Linien des Natriums unterscheiden zu können. Det är en engelsk kollege Edward Frankland som är en del av det nya elementet efter dem grichischen Wort für Sonne zu benennen. Da sie annahmen, dass es sich bei dem Element um ein Metall handelte, hängt sie dem Namen die für Metalle übliche Endung -ium anstatt der üblichen Endung für Edelgase -on .
Am 26. März 1895 gewann der britische Chemiker William Ramsay Helium, indem er das Uran-Mineral Cleverit mit Mineralsäuren versetzte und das dabei austretende Gas isolierte. Er war auf der Suche nach Argon, coulde jedoch die gelbe D3-Linie beobachten, nachdem er Stickstoff and Sauerstoff von dem isolierten Gas getrennt hatte. Dieselbe Entdeckung machten fast gleichzeitig der britische Physiker William Crookes und die schwedischen Chemiker Per Teodor Cleve und Nicolas Langlet i Uppsala i Schweden. Diese sammelten ausreichende Mengen des Gases um dessen Atommasse feststellen zu können.
Bei einer Ölbohrung in Dexter in Kansas wurde eine Erdgasquelle gefunden, deren Erdgas zwölf Volumenprozent eines unbekannten Gases enthielt. Die amerikanischen Chemiker Hamilton Cady und David McFarland der Universität von Kansas fanden heraus, that es sich dabei um Helium handelte. Om du publicerar en anmälan kan Helium aus Erdgas vinnas. Im selben Jahr stellten Ernest Rutherford und Thomas Royds fest, dass Alphateilchen Heliumkerne sind.
Die erste Verflüssigung Heliums wurde 1908 vom niederländischen Physiker Heike Kamerlingh Onnes durchgeführt, indem er das Gas auf eine Temperatur von unter 1 Kühlte. Det är bättre än en temperatur på 0,8 K för att vara säker, scheitera, då Helium nur bei Druck verfestigt kan. Onnes beschrieb ebenfalls zum ersten Mal den heute nach ihm benannten Onnes-Effekt. Die erste Verfestigung wurde 1926 von Onnes' Student Willem Hendrik Keesom durchgeführt, der Helium auf eine ähnliche Temperatur abkühlte and einen Druck von 25 bar anwandte.
Natürliches Vorkommen
Im Weltall
Entsprechend der Urknalltheorie entstand der größte Teil des heute im Weltraum vorhandenen Heliums in den ersten drei Minuten nach dem Urknall. Das große Vorkommen im Universum unterstützt die Urknalltheorie. Helium ist nach Wasserstoff das zweithäufigste Element. 23 % der Masse der sichtbaren Materie bestehen aus Helium, obwohl Wasserstoffatome achtmal häufiger sind. Außerdem wird Helium durch Kernfusion in Sternen produziert. Dessa så kallade Wasserstoffbrennen liefert die Energie, die die Sterne auf der Hauptreihe, also die Mehrheit aller Sterne, zum Leuchten bringt. Dieser Prozess älskar den Sternen die Energie för den größten Teil ihres Lebens. Wenn der größte Teil des Wasserstoffes am Ende des Lebens eines Sterns im Kern aufgebraucht ist, zieht sich der Kern zusammen und erhöht seine Temperatur. Dadurch kann nun Helium zu Kohlenstoff verbrannt werden (Heliumflash, Heliumbrennen). In eine Schale um diesen Kern findet weiterhin das Wasserstoffbrennen satt. Auch Kohlenstoff kan weiter zu andra Elementen verbrannt werden. Dieser Prozess wird vanligtvise bis zum Eisen fortgesetzt, falls keine Supernovaexplosion auftritt. Vid en supernovaexplosion blev en schwerere element som syntetiserats av Eisen, genom explosionen i världsrummet. Im Verlauf der Zeit reichert sich die interstellare Materie dadurch mit Helium und schwereren Elementen an, so dass später entstandene Sterne auch einen größeren Anteil an Helium und schwereren Elementen haben.
Auf Sternoberflächen und in Nebeln kommt Helium bevorzugt neutral oder einfach ionisiert vor. Anders als in der Physik und Chemie üblich, wird in der Astronomie aber nicht die Notation mit hochgestelltem „+“ (He) verwendet, da andere Elemente so hochionisiert vorkommen können, dass diese Notation unpraktisch wird, zum Beispiel sechzehnfach ionisiertes Eisen in der Sonnenkorona. Daher werden Ionisationsstufen in der Astronomie mit römischen Ziffern bezeichnet, wobei neutrales Helium as He-I bezeichnet wird, einfach ionisiertes entsprechend He-II and fullständig ionisiertes as He-III.
Helium ist auch in verschiedenen Planetatmosphären vorhanden:
| Neptun | 19 % ± 3,2 % |
| Uranus | 15,2 % ± 3,3 % |
| Jupiter | 10,2 % |
| Merkur | 6 % |
| Saturnus | 3,25 % |
| Venus | 12 ppm |
| Erde | 5,2 ppm |
Meteoriten und Mond
Helium kan in Meteoriten auch durch Wechselwirkung (Spallation) mit Kosmischer Strahlung erzeugt werden. Besonders Han kan deswegen benutzt werden, um sogenannte Bestrahlungsalter, welches meist dem Zeitraum zwischen dem Losschlagen des Meteoriten vom Mutterköper bis zu seiner Ankunft auf der Erde entspricht, zu bestimmen. Daneben entsteht Han i Meteoriten durch Zerfall schwerer radioaktiver Elemente. Auch gibt es in Meteoriten weitere Heliumanteile, welche aus der Zeit der Entstehung des Sonnensystems stamen, zum Teil aber auch aus dem Sonnenwind aufgefangen wurden. Ähnliches gilt auch für Mondgestein, welches von der Oberfläche des Mondes stammt. Da dieses oft sehr lange dem Sonnenwind bzw. der Kosmischen Strahlung ausgesetzt war ist solches Mondgestein besonders reich an Helium, insbesondere dem Isotop He. Sollte es gelingen Kernfusionsreaktoren für die Deuterium-Tritium-Fusion zu entwickeln, könnte die Gewinnung von Helium-3 vom Mond wirtschaftlich interessant werden. Der gegenwärtige Energiebedarf Chinas erforderte jährlich 3 Tonnen Helium-3 .
Auf der Erde
Han entsteht im Erdkörper beim radioaktiven Zerfall (Alphazerfall) schwerer Elemente wie Uran oder Thorium, wobei Helium-Kerne as Alphateilchen ausgesandt werden und anschließend Elektronen einfangen. Es kann in verschiedenen uran- und thoriumhaltigen Mineralen wie der Pechblende gefunden werden.
Aus der Entstehungszeit der Erde stammt ein Anteil von He im Erdmantel, der weit über dem atmosphärischen Wert ligger, das sogenannte Mantelhelium; Das He/He-Verhältnis ligger i oberen Erdmantel, där weitgehend entgast ist och dess Heliumfil daher im wesentlichen durch He aus Alpha-Zerfällen wiederaufgefüllt wird, bei etwa 86.000. Wenn das Konvektionssystem des unteren Erdmantels weitgehend von dem des oberen getrennt und der Massenaustausch zwischen beiden entsprechend gering ist, liegt das Verhältnis im unteren, kaum entgasten Mantel zwischen 2.500 und 26.000, das Heite von He. Den speciella geodynamiska intressen är inblick i Ursachen av Hotspot-Vulkanismus:under basalte av mittelozeanischen Rücken, die under Schmelzprozesse av Material des oberen Mantels entstehen, He/He =86.000 typisch ist, Show Basalte, Zum Einigen Hotspot o Vulkaninseln wie Hawaii und Island, Werte auf, die um etwa das Drei- bis Vierfache niedriger liegen. Dies wird gemeinhin damit erklärt, dass dieser Vulkanismus durch Mantelplumes verursacht wird, deren Ursprung an der Kern-Mantel-Grenze ligger und die daher zumindest teilweise aus Material des unteren Erdmantels bestehen.
Helium kommt in geringen Mengen in der Erdatmosphäre (5,2 ppm) sowie in Erdgas und Erdöl (0,4 %) vor. Der Anteil Heliums an der Erdatmosphäre ist so niedrig, das meiste Helium, das auf der Erde entsteht, wegen seiner Leichtigkeit und aufgrund der Tatsache, dass es sich kaum mit anderen Elementen verbindet, in den Weltraum entweicht. Ungefähr 1000 km über dem Meeresspiegel ist Helium das vorherrschende Element, da es sich dort ansammelt. Das Helium dort könnte aber auch durch den Einfang des Sonnenwindes herrühren.
Künstliche Gewinnung
Erdgas mit einem Heliumanteil bis zu 7 % ist der größte und wirtschaftlich wichtigste Heliumlieferant. Da Helium sehr niedrige Schmelz- und Siedetemperaturen besitzt, sind sehr niedrige Temperaturen nötig, um es von den anderen, im Erdgas enthaltenen Stoffen wie Kohlenwasserstoffen und Stickstoffverbindungen zu trennen.
Viele Jahre lang vinna die USA över 90 % des kommerziell benutzbaren Heliums der Welt. Noch 1995 blev in den USA insgesamt eine Milliarde Kubikmeter Helium gefördert. Der restliche Anteil wurde von Förderungsanlagen in Kanada, Polen, Russia (wobei große Mengen in den völlig unzugänglichen Gebieten Sibiriens liegen) and other Ländern geliefert. Nach der Jahrtausendwende kamen Algerien und Katar dazu. Algeriet kunde sich rasch zum zweitwichtigsten Heliumlieferanten entwickeln. 2002 stellte Algeriet 16 % des Heliums her, das in der Welt vertrieben wurde.
Bei Amarillo i Texas lagerte 2004 etwa das Zehnfache des Weltjahresbedarfs an Helium. Dessa ehemals strategische Reserve der amerikanischen Regierung muss aufgrund des Helium Privatization Act der Clinton-Regierung aus dem Jahr 1996 innerhalb der nästa Jahre an die Privatwirtschaft verkauft werden.
Das Isotop He ist nur zu ca. 1,4 ppm i natürlichem Helium enthalten und ist daher sehr teuer. Principiellt kan es auch aus Kernreaktionen vann. Es entsteht beispielsweise beim Betazerfall von Tritium:
Tritium och Helium-4 kan användas genom Neutronenbeschuss av Litium i en Kernreaktor som har vunnits:
Geschichte der künstlichen Gewinnung
Im frühen 20. Jahrhundert wurden große Mengen Helium in Erdgasfeldern der amerikanischen Great Plains gefunden und halfen den Vereinigten Staaten, der führende Weltlieferant für Helium zu werden. Sir Richard Threlfalls förde ett första steg från US-Marine som små experimentella Heliumproduktionsbetriebe under Ersten Weltkrieges, om Helium som Füllgas för Sperrballone zu gewinnen. En sammanfattning av 5700 Kubikmeter Gas med en Heliumanteil från 92 % kommer från diesen Betrieben hergestellt, obwohl vorher nur wenige hundert Liter des Gases gewonnen were were. Kleine Mengen dieses Gases wurden im ersten heliumgefüllten Luftschiff der Welt benutzt, dem C-7 der US-Navy, som sena Jungfernfahrt auf der Strecke von Hampton Roads in Virginia nach Boiling Field in Washington, D.C. am 7. December 1921 bestritt.
Die Regierung der USA ließ 1925 die National Helium Reserve in Amarillo in Texas errichten, um eine Versorgung von militärischen Luftschiffen in Kriegszeiten und Verkehrsluftschiffen in Friedenszeiten zu sichern. Obwohl die Nachfrage nach dem Zweiten Weltkrieg sjönk, wurde die Förderungsanlage in Amarillo erweitert, damit flüssiges Helium as Kühlmittel für Sauerstoff-Wasserstoff-Raketentreibstoff and other zu kühlende Gegenstände bereitgestellt were could could. Der Heliumverbrauch der USA stieg im Jahr 1965 auf das Achtfache des Spitzenverbrauchs in Kriegszeiten.
Nachdem in den USA das Helium Acts Amendments of 1960 (Public Law 86-777) beschlossen wurde, wurden weitere fünf private Heliumförderanlagen errichtet. Detta US-Minenministerium ligger på en 685 kilometer lång pipeline från Bushton i Kansas och Amarillo i Texas bygga.
Die Reinheit des gewonnenen Heliums stieg nach dem Zweiten Weltkrieg rasant an. Wurde 1945 noch en Mischung av 98 Prozent Helium och 2 Prozent Stickstoff för Luftschiffe utnyttjat, kunde 1949 bereits Helium mit einer Reinheit av 99.995 Prozent kommerziell vertrieben werden. Um diesen Reinheitsgrad zu erreichen, ist Aktivkohle nötig, um verbliebene Verunreinigungen – meistens bestehend aus Neon – mittels Druckwechsel-Adsorption zu entfernen.
Egenskaper
Helium ist nach Wasserstoff das Chemical Element mit der geringsten Dichte und besitzt die niedrigsten Schmelz- und Siedepunkte aller Elemente. Daher existiert es nur unter sehr tiefen Temperaturen as Flüssigkeit oder Feststoff. Bei Temperaturen unter 2,17 K ligger He in einer suprafluiden Phase vor. Bei Normaldruck wird Helium selbst bei einer Temperatur von 0 K nicht fest. Erst bei einem Druck oberhalb 2,5 MPa (ca 25-facher Atmosphärendruck) geht Helium bei hinreichend tiefen Temperaturen in eine feste Phase über.
Im gasförmigen Zustand
Helium ist ein farbloses, geruchloses and ungiftiges Gas. Unter Standardbedingungen verhält sich Helium nahezu wie en ideals Gas. Helium ist unter praktisch allen Bedingungen einatomar. En Kubikmeter Heliumhatt vid Standardbedingungen en massa av 179 g. Luft hat dagen die etwa siebenfache Dichte. Helium weist nach Wasserstoff die größte thermische Leitfähigkeit unter allen Gasen auf, und seine spezifische Wärme ist außergewöhnlich groß. Helium är en elektrisk isolator. Die Wasserlöslichkeit von Helium är geringer som vid jedem andra Gas. Seine Diffusionsrate durch Festkörper beträgt das Dreifache von Luft und circa 65 % von Wasserstoff . Helium hat bei Standardbedingungen einen negativen Joule-Thomson-Koeffizienten, das heißt, dieses Gas erwärmt sich bei Ausdehnung. Erst unterhalb der Joule-Thomson-Inversionstemperatur (cirka 40 K vid Atmosphärendruck) kühlt es sich bei Expansion ab. Daher muss Helium unter diese Temperatur vorgekühlt werden, ehe es durch Expansionskühlung verflüssigt werden kann.
Im flüssigen Zustand
Helium I
Unter dem Siedepunkt bei 4,21 Kelvin und über dem Lambdapunkt bei 2,1768 K ist das Isotop He eine farblose Flüssigkeit. Es wird Helium I genannt. Wie andra extrema kalte Flüssigkeiten siedet Helium I, wenn es erhitzt wird, und zieht sich zusammen, wenn seine Temperatur verringert wird. Bei Erreichen des Lambdapunktes expandiert es spontan. Der Grad der Expansion verringert sich, bis ungefähr 1 K erreicht werden. Bei dieser Temperatur stopt die Expansion, und das Helium beginnt, sich wieder zusammenzuziehen.
Helium II
Flüssiges He entwickelt unterhalb seines Lambdapunktes sehr ungewöhnliche Eigenschaften. Helium mit diesen Eigenschaften wird as Helium II bezeichnet. Das Sieden von Helium II ist wegen seiner hohen Wärmeleitfähigkeit nicht mehr möglich. Erhitzen bewirkt stattdessen eine direkt Verdampfung der Flüssigkeit in the gasförmigen Zustand, when the „Siedepunkt“ erreicht ist.
Helium II är ett suprafluider Stoff. So fließt es etwa durch kleinste Öffnungen in Größenordnungen von 10 bis 10 m und hat keine messbare Viskosität. Jedoch kunde bei Messungen zwischen två sich flytta den Scheiben ene Viskosität ähnlich der von gasförmigem Helium festgestellt werden. Dies wird mit einer Theorie erklärt, nach der sich in flüssigem Helium unterhalb des Lambdapunktes sowohl ein Anteil an Heliumatomen ohne jegliche Viskosität und ein Anteil von Heliumatomen mit Viskosität befindet.
Helium II seigt wie andra suprafluide Flüssigkeiten den Onnes-Effekt:Wenn eine Oberfläche aus dem Helium hinausragt, bewegt sich das Helium auf dieser Fläche auch gegen die Schwerkraft. Helium II entweicht auf diese Weise aus einem Behälter, der nicht versiongelt ist. Wenn es einen wärmeren Bereich erreicht, verdunstet es. Aufgrund dieses Kriechverhaltens und der Fähigkeit des Heliums II, selbst durch kleinste Öffnungen auszulaufen, ist es sehr schwierig, flüssiges Helium in einem begrenzten Raum zu halten. Es ist ein sehr sorgfältig zu konstruierender Behälter nötig, um Helium II aufzubewahren, ohne dass es entweicht oder verdunstet.
Die Wärmeleitfähigkeit von Helium II ist größer als die jeder anderen bekannten Substanz, was durch den Effekt des zweiten Schalls beschrieben wird. Sie ist eine Million mal höher als die von Helium I und mehrere hundert Mal höher as die des Kupfers. Sie ist so hoch, weil die Wärmeübertragung durch quantenmechanische Effekte bestimmt wird. Die meisten gut wärmeleitenden Materialien besitzen ein Valenzband freier Elektronen, die die Wärme gut leiten. Helium II hat kein solches, sondern leitet den Wärmepuls mit einer Geschwindigkeit von 20 m/s bei 1,8 K. Dieser Vorgang kan durch eine Wellengleichung beschrieben werden.
1971 gelang David M. Lee, Douglas D. Osheroff och Robert C. Richardson, som Helium-Isotop. Dabei geht man davon aus, dass zwei Atome He ein Paar bilden, ähnlich einem Cooper-Paar. Dieses Paar besitzt ett magnetiskt ögonblick och ett Drehmoment. Die drei Wissenschaftler erhielten für diese Entdeckung 1996 den Nobelpreis für Physik.
Im festen Zustand
Helium kan als einziger Stoff unter Normaldruck nicht verfestigt werden. Dies gelingt aber unter leicht erhöhtem Druck (etwa 2,5 MPa) und bei sehr niedriger Temperatur (weniger als 1,5 K). Der beim Phasenübergang entstehende, snabb vollkommen durchsichtige Feststoff ist sehr stark komprimierbar. Im Labor kan dess Volumen um bis zu 30 % verringert werden; Helium är mehr als 50-mal besser komprimierbar als Wasser. Im festen Zustand bilden är kristallin Strukturen aus. Festes und flüssiges Helium sind optisch kaum voneinander zu unterscheiden, da ihre Brechzahlen fast gleich sind.
In einem anderen Fall kan bei Erreichen von nahezu 0 K und gleichzeitigem Zentrifugieren ein Zustand erreicht werden, den man suprafest nennt. Hierbei stoppt ein Teil des Feststoffes die eigene Rotation und durchdringt die restlichen Teile der Materie. Dazu gibt es noch keine bekannten Thesen oder Theorien.
Aufbau
Das mit Abstand häufigste Isotop He hat einen Atomkern aus zwei Protonen and zwei Neutronen sowie eine Elektronenhülle mit zwei Elektronen. Ein zweites stabiles Isotop ist He, bei dem der Atomkern neben den zwei Protonen nur ein Neutron besitzt. Weiterhin gibt es eine Reihe kurzlebiger Isotope mit drei und mehr Neutronen (sehe Tabelle „Isotope“), die aber nur theoretisch intressant sind.
Elektronenzustände des Heliumatoms
Die zwei Elektronen des Heliumatoms bilden die abgeschlossene, kugelsymmetrische Elektronenschale des 1s-Orbitals. Denna Elektronenkonfiguration är energetisk äußerst stabil, es gibt kein other Element mit einer höheren Ionisierungsenergie und einer geringeren Elektronenaffinität. Helium ist trotz seiner größeren Elektronenzahl kleiner als Wasserstoff und damit das kleinste Atom überhaupt.
Abhängig von der Spinorientierung der zwei Elektronen des Heliumatoms spricht man vom Parahelium im Falle von zwei antiparallelen Spins (S=0) und von Orthohelium bei zwei parallelen Spins (S=1). Beim Orthohelium befindet sich eines der Elektronen nicht im 1s-Orbital, da dies das Pauli-Verbot verletzen würde.
Die Benennung dieser Zustände geht auf einen früheren Irrtum zurück:Da der elektromagnetische Übergang zwischen dem Grundzustand des Orthoheliums und dem Grundzustand des Paraheliums (även dem Helium-Grundzustand) verboten ist, erscheinen die beiden „Varianten“ wienthesed heliumsschiede. Dies führte dazu, dass Carl Runge und Louis Paschen postulierten, Helium bestehe aus zwei getrennten Gasen, Orthohelium („richtiges Helium“) und Parahelium (für das sie den Namen Asterium vorschlugen).
Neben der Elektronenkonfiguration des Orthoheliums können die Elektronen – zum Beispiel durch Beschuss mit Elektronen – weitere angeregte Zustände einnehmen. Dessa långlebigen angeregten Zustände blev som metastabila energinivåer bezeichnet.
Chemische Eigenschaften
Helium är ett Edelgas. Die einzige Elektronenschale ist mit zwei Elektronen voll besetzt. Beide Elektronen synd durch die räumlich Nähe zum Atomkern sehr stark an diesen gebunden. Nicht zuletzt deswegen ist Helium selbst im Vergleich zu anderen Edelgasen ausgesprochen reaktionsträge. Das zeigt sich auch an den hohen Ionisierungsenergien des Heliumatoms.
Helium-Dimer
Wie anhand des Molekülorbital-Schemas ersichtlich wird, bild Helium-Atome untereinander keine chemische Bindung. Beim Helium ist das 1s-Orbital mit einem Elektronenpaar besetzt. Bei der Kombination zweier dieser Atomorbitale ist sowohl das bindende as auch das antibindende Molekülorbital mit je einem Elektronenpaar besetzt. Ihre Wirkungen heben sich gegenseitig auf, es kommt keine Bindung zustande.
| Besättning der Orbitale eines hypothetischen He2 -Moleküls. |
Aufgrund der für alle Atome och Moleküle wirksamen van-der-Waals-Wechselwirkung existiert jedoch auch bei Helium ein Dimer, allerdings mit einer äußerst kleinen Bindungsenergie von circa 1,1 mK (=9,5·10 J ) and einem entsprechend großen ca 52 Å.
Joniska Bindungen
Unter extremen Bedingungen ist es möglich, eine quasichemische Verbindung von Helium mit einem Proton (HeH) zu erzeugen. Dessa anslutningar är inte normala och kan inte vara instabila i form av en Salzes där HeHX isoleras.
-
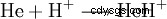
- I ett gemisch av Helium och Wasserstoff bild sich under ener elektrisk Entladung ein Heliumhydrid-Ion
En entsprechende Reaktion kan två andra Helium-Atomen ablaufen, när den för Ionisierung notwendige Energie zugeführt wird.
Diese Verbindungen können aber nicht as wirkliche chemische Verbindungen bezeichnet werden, sondern eher as ionische Agglomerationen, die unter Ausnahmebedingungen kurz entstehen und sofort wieder zerfallen.
Isotope des Heliums
Han och han
| Verschiedene egenskaper der heliumisotop | Han | Han |
|---|---|---|
| Dichte i g/cm³ | 0,082 | 0,145 |
| Kritisk temperatur i K | 3,32 | 5,20 |
| Lambdapunkt i K | 0,0025 | 2,1768 |
| Schmelzdruck bei T =0K i MPa | 3 439 | 2 536 |
| Siedepunkt i K | 3,19 | 4,21 |
Von den acht bekannten Isotopen des Heliums sind lediglich He und He stabil. In der Erdatmosphäre existiert pro Million He-Atome nur ein He-Atom. Jedoch variiert die Proportion der beiden Isotope je nach dem Herkunftsort der untersuchten Heliumprobe. Im interstellaren Medium sind He-Atome hundert Mal häufiger. In Gesteinen der Erdkruste und des Erdmantels ligger die Proportion ebenfalls weit über dem atmosphärischen Wert und variiert je nach Herkunft um den Faktor 10. Diese Variationen werden in der Geologie benutzt, um die Herkunft des Gesteines zu klären (siehe auch Natürliches Vorkommen). P>
He und He show aufgrund der unterschiedlichen Symmetrieeigenschaften (He-Atome sind Fermionen, He-Atome sind Bosonen) enige unterschiedliche physikalische Eigenschaften auf, die sich insbesondere bei tiefen Temperaturen zeigen. Så trennen sich gleiche Anteile von flüssigem He und He unter 0,8 Kelvin aufgrund ihrer unterschiedlichen Quanteneigenschaften in zwei unmischbare Flüssigkeiten, ähnlich Öl und Wasser. Weiterhin unterscheiden sich die zwei Isotope deutlich in ihren suprafluiden Phasen (siehe Abschnitt „Helium II“).
Kernfusion
Im Kontext von angekündigten, neuen Raumfahrt-Missionen der USA, Russlands und Chinas, weiterhin auch Europas, Indiens and Japans zum Mond word die dortigen anteilig größeren Vorkommen von Han läser som lohnende Quelle genannt, um Kernfusion auf Basis dieses Isotops auf der Erde zu ermöglichen . Im Vergleich zu der Alternative auf Deuterium/Tritium-Basis ist He weniger radioaktiv, verlangt aber wiederum höhere Temperaturen .
Hypotetiska diprotoner
Ein besonderes, fiktives Isotop des Heliums ist das Diproton, das im Falle seiner Existenz lediglich aus zwei Protonen und zwei Elektronen bestehen würde. Detta är inte möjligt, vilket innebär att den har ett starkt kännetecken för Protonen genom att den starke Kernkraften i hösten inte kommer att kompenseras. Die Neutronen sind offenbar notwendig, um as „Kitt“ den Atomkern zusammenzuhalten.
Användning
Unter hohem Druck abgefülltes Helium ist frei verkäuflich und wird aus Erdgas gewonnen. Es wird für viele verschiedene Zwecke benutzt, für die ein Gas mit mindestens einer der vorteilhaften Eigenschaften des Heliums benötigt wird, zum Beispiel sein niedriger Siedepunkt, die geringe Dichte, die geringe Löslichkeit, die hohe Wärmeleitfähigkeit oder sein reaktionsträges Verhalten.
- Helium-Sauerstoff-Gemische (80:20) dienen für Asthmatiker als Beatmungsgas – die Viskosität des Gasgemisches ist wesentlich geringer als die von Luft und es lässt sich daher leichter atmen.
- Beim kommerziellen Tauchen werden verschiedene Gemische mit Helium wie Trimix (bestehend aus Sauerstoff, Stickstoff und Helium) als Atemgas verwendet.
- Da Helium nur ein Siebtel der Dichte von Luft hat, dient es auch als Traggas für Ballons oder Luftschiffe. Durch sein inertes Verhalten und seine Unbrennbarkeit hat es das Traggas Wasserstoff weitgehend verdrängt, auch wenn Dichte und damit Tragfähigkeit ungünstiger als bei Wasserstoff und die Kosten deutlich höher sind.
- In der Schweißtechnik wird Helium in Reinform oder als Zumischung als Inertgas eingesetzt, um die Schweißstelle vor Sauerstoff zu schützen. Zudem lässt sich bei Einsatz von Helium die Einbrenntiefe und die Schweißgeschwindigkeit steigern sowie die Bildung von Spritzern verringern, was insbesondere bei Roboterschweißungen und bei der Verarbeitung von Aluminium und rostfreien Stählen zum Einsatz kommt.
- Technisch wird verflüssigtes Helium (die Isotope He und He) als Kühlmittel zum Erreichen tiefer Temperaturen (etwa 1 bis 4 Kelvin) eingesetzt (siehe dazu: Kryostat). Mit He lassen sich durch Verdampfungskühlen Temperaturen bis etwa 1 K erreichen. Das Isotop He erlaubt den Einsatz als Kühlmittel bis etwa 1 mK. Gerade beim Einsatz von supraleitenden Magneten dient Helium als Kühlmittel, damit die Supraleiter vom Typ I unter der Sprungtemperatur bleiben. Praktische Anwendungen sind hier die Kernspintomographie (MRT), die Magnetoenzephalographie (MEG) in der Medizintechnik sowie die Magnetresonanzspektroskopie (NMR) in der Forschung. Ebenso kann komprimiertes Heliumgas als Kühlmittel eingesetzt werden, insbesondere dort, wo ein besonders inertes Kühlmittel benötigt wird. Als Beispiel sei der Thorium-Hochtemperaturreaktor (kurz THTR) genannt. Ein weiteres Anwendungsgebiet ist hier die Herstellung von optischen Glasfasern in heliumgekühlten Falltürmen. Zu beachten ist, dass Helium zwar eine hohe spezifische aber eine niedrige molare Wärmekapazität besitzt. Dies ist insbesondere bei geschlossenen Apparaturen problematisch, da es im Falle eines Temperaturanstiegs (zum Beispiel bei Stromausfall) schnell zu einer massiven Druckerhöhung kommt.
- Bei Vakuumanlagen wird Helium als Lecksuchgas eingesetzt, indem die Vakuumapparatur mit einer Pumpe evakuiert wird und ein Massenspektrometer hinter die Pumpe gehängt wird. Wird nun die Apparatur mit Helium angeblasen, kann mit Hilfe des Massenspektrometers ein eventueller Heliumeintritt in die Apparatur detektiert und somit die Leckrate gemessen werden. Diese Eigenschaft wird unter anderem auch bei der Lecksuche in Chemieanlagen und bei der Fertigung von Wärmeübertragern für Klimaanlagen oder Benzintanks für Autos benutzt.
- Helium wird in Gasform in der Raketentechnik eingesetzt, um bei pumpgeförderten Flüssigtreibstoffraketen den verbrauchten Treibstoff zu ersetzen, damit die dünnwandigen Treibstofftanks der Raketen nicht implodieren, wenn der Treibstoff von den Treibstoffpumpen der Triebwerke aus den Tanks gesaugt wird. Bei druckgasgeförderten Flüssigtreibstoffraketen drückt Helium den Treibstoff in die Triebwerke. Helium wird hier aufgrund seines niedrigen Gewichtes und niedrigen Siedetemperatur benutzt. Da es als Edelgas nicht mit dem Treibstoff reagieren kann, stellten auch aggressive Hypergolische Treibstoffe kein Problem dar.
- Helium wird in zwei Lasertypen eingesetzt:Dem Helium-Neon-Laser und dem Helium-Cadmium-Laser.
- Reinsthelium dient zudem als Trägergas in der Gaschromatographie (Analytik).
- In Gasentladungsröhren leuchtet Helium gelblich/weiß.
- Aufgrund seiner thermodynamischen Eigenschaften ist Helium das beste Arbeitsmedium für Stirlingmotoren.
- Hyperpolarisiertes He wird in der Diagnostik versuchsweise als Kontrastmittel für kernspintomographische Aufnahmen der Lunge verwendet.
Gefahren
| Sicherheitshinweise | |
|---|---|
| R- und S-Sätze | R:- S:9, 23, (36 falls tiefgekühlt) |
Obwohl Helium an sich ungiftig ist und unter Umweltbedingungen keine chemischen Verbindungen eingeht, wird davon abgeraten, das Gas einzuatmen oder in geschlossene Räume ausströmen zu lassen, da Helium den Sauerstoff verdrängt und somit zu Sauerstoffmangel führen kann. Dies kann zu dauerhaften Gesundheitsschäden bis hin zum Tod führen. Symptome können Orientierungsschwierigkeiten und Bewusstseinsverlust sein. Das Gefährliche daran ist, dass das Opfer die Erstickung kaum bis gar nicht bemerkt, bis es zu spät ist. Beim Verwenden von Helium-Flüssiggas ist die Verwendung von Schutzkleidung notwendig, um Erfrierungen zu vermeiden. Heliumbehälter stehen unter hohem Druck und dürfen daher nicht erhitzt oder mit Feuer in Verbindung gebracht werden, weil sie explodieren, wenn der Innendruck zu stark wird.
Sonstiges
Nach dem Einatmen von Helium ändert sich die eigene Stimme dramatisch (zu einem „Mickymaus“-Piepsen). Die Klangfarbe einer Stimme hängt ab von der Lage der Resonanzfrequenzen im Mundraum, den sogenannten Formanten, die durch Faktoren wie Zungen- und Lippenstellung beeinflusst werden können. Darüber hinaus hängt die Lage dieser Resonanzfrequenzen auch von der Schallgeschwindigkeit ab, die in verschiedenen Medien unterschiedlich ist (cLuft =350 m/s, cHelium =1030 m/s). Beträgt zum Beispiel die Lage der ersten drei Formanten in Luft 220, 2270 und 3270 Hz, so ändert sich dies in Helium zu 320, 3900 und 5500 Hz. Dadurch ergibt sich ein anderes Stimmbild, und die Stimme erscheint insgesamt höher, auch wenn die Höhe des Stimmtones selbst durch das Edelgas unverändert bleibt.
Literatur
- Harry H. Binder:Lexikon der chemischen Elemente . Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
- John Emsley:The elements . Clarendon Press, Oxford ³1998, ISBN 0198558198
- A. F. Holleman, Egon Wiberg:Lehrbuch der Anorganischen Chemie . de Gruyter, Berlin 1995, ISBN 3-11-012641-9
- F. A. Cotton, G. Wilkinson, C. A. Murillo, M. Bochmann:Advanced Inorganic Chemistry. Kap. 18 D. Wiley, New York 1999, S. 974, ISBN 0-471-19957-5
- C. E. Housecroft, A. G. Sharpe:Inorganic Chemistry . Kapitel 22.8a. Pewson, Prentice Hall 2005, S. 666. ISBN 0130-39913-2
- Ekkehard Fluck, Klaus G. Heumann:Periodensystem der Elemente, Tafel . Wiley-VCH, Weinheim 2002, ISBN 3-527-30716-8
- R. B. King (Hrsg.):Encyclopedia of Inorganic Chemistry . Bd 8. Wiley, New York 1994, S. 4094, ISBN 0-471-93620-0
andere Quellen
- ↑ Stoffdatenblatt Helium (verdichtet)
- ↑ Rainer Kayser:Langer Marsch China will zum Mond ., in Die Rheinpfalz am Sonntag vom 8. Juli 2007, S. 20
- ↑ The Encyclopedia of Chemical Elements, Seite 261
- ↑ Zur Umrechnung von in Kelvin angegebenen Energieeinheiten in Joule siehe Kelvin#Temperatur und Energie
- ↑ R. E. Grisenti; W. Schöllkopf; J. P. Toennies; G. C. Hegerfeldt; T. Köhler; M. Stoll, Determination of the Bond Length and Binding Energy of the Helium Dimer by Diffraction from a Transmission Grating , Phys. Rev. Lett. 85 , 11, 2000, S. 2284-2287. [1]
- ↑ 'Energie vom Mond', heise.de/tr , 31.08.2007
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| Alkalimetalle | Erdalkalimetalle | Lanthanoide | Actinoide | Übergangsmetalle | Metalle | Halbmetalle | Nichtmetalle | Halogene | Edelgase |