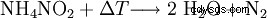| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Namn, symbol, Ordnungszahl | Stickstoff, N, 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | Nichtmetall | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupp, Periode, Block | 15, 2, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | Farbloses Gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,03 % | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 14 0067 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 65 (56) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radie | 19.00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [He]2s2p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronen för energinivå | 2, 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 1402 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 2856 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 4578 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 7475 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 9445 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikalisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | gasförmig | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifikationen | 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | sexkantig | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 1 2506 kg · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | keine (gas) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetism | diamagnetisk | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 63,14 K (−210,01 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 77,35 K (−195,80 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 22,42 · 10 m/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungswärme | 5 5856 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzvärme | 0,7208 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dampfdruck | ? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 334 m/s vid 298,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 1040 J/(kg · K) vid 298 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 0 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,02598 W/(m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | −3, 1, 2, 3 , 4, 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxid (Basizität) | N2 O, NEJ, N2 O3 , NEJ2 , N2 O5 (stark sauer) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 3,04 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gefahrstoffkennzeichnung | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R- och S-Sätze | R:keine R-Sätze | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S:9-23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich and gebräuchlich, were SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Namnet Stickstoff (lat. Nitrogenium ) bezeichnet das chemische Element aus dem Periodensystem der Elemente mit dem Symbol N und der Ordnungszahl 7. Atomar kommit Stickstoff in der Natur kaum vor, da es sich sofort durch eine stark exotherme Reaktion zu molekularem Stickstoff N2 verbindet. Elementar tritt Stickstoff nur in Form eines kovalenten Homodimers, einer chemin Verbindung aus zwei Stickstoff-Atomen, auf (→ molecularer Stickstoff , auch Distickstoff (vgl. Disauerstoff), Summenformel N2 ).
Molecularer Stickstoff ist der Hauptbestandteil der Luft. Er ist für die Lebewesen ein essentielles Element, das durch Stickstofffixierung auf natürlichem Wege organisch gebunden wird. I organisk form är Baustein der Proteine ein wichtiges Hauptelement aller Organismen. Stickstoff ist ein zentrales Element im Stickstoffkreislauf der Ökosysteme und wird von den Lebewesen in einem energiintensiven Prozess organisch gebunden und tillgänglig gemacht. Er kommt in Mineralien sehr selten vor. Auf der Erdoberfläche und in der Luft är snabbt ausschließlich abiotisch in der Anfangszeit der Erde entstanden och wurde später von den Lebewesen gebunden.
Das Elementsymbol N leitet sich von der lateinischen Bezeichnung nitrogenium (von altgriech. νιτρον „Laugensalz“ und altgriech. γενος „Herkunft“) ab. Die deutsche Bezeichnung Stickstoff erinnert daran, dass molekularer Stickstoff Flammen löscht („erstickt“) oder dass ein Lebewesen (z. B. ein Mensch) in reinem Stickstoff erstickt.
Historik
Chemische Verbindungen des Stickstoffs, wie Nitrate und Ammoniumsalze, were schon von Alchemisten verwendet. Carl Wilhelm Scheele wies 1771 Stickstoff als Bestandteil der Luft nach. Erstmals im Jahr 1774 blev Ammoniak av Joseph Priestley dargestellt. Durch die Einführung des Frank-Caro-Verfahrens (Kalkstickstofferzeugung nach Adolph Frank und Nikodem Caro) wurde der Luftstickstoff erstmals Anfang des 20. Jahrhunderts nutzbar gemacht. Ebenfalls Anfang des 20. Jahrhunderts wurden weitere wichtige Verfahren großtechnisch verfügbar. Zu diesen Verfahren zählen unter anderem die Gewinnung von Salpetersäure (Birkeland-Eyde-Verfahren, nach Kristian Birkeland och Sam Eyde), die katalytische Ammoniakverbrennung nach Wilhelm Ostwald sowie die Ammoniaksynthese nach Fritz Haber och Carl Bosch.
Natürliches Vorkommen und Kreislauf des Stickstoffs
Schon im 19. Jahrhundert erkannte man, dass ein großer Teil der pflanzlichen Materie Stickstoff enthält und ein wichtiges Bauelement aller Lebewesen ist. Er ist das wesentliche Element der Proteine und Proteide (Eiweißstoffe) und der DNA. Stickstoff ist daher auch Baustein aller Enzyme, die den pflanzlichen, tierischen and menschlichen Stoffwechsel steuern. Stickstoff ist für jedes Leben unentbehrlich.
Stickstoff in der Luft
Die Lufthülle der Erde besteht zu 78,09 vol% (75,53 % Gewichtsanteil) aus molekularem Stickstoff. Lediglich eine kleine Anzahl von Mikroorganismen kan ihn nutzen, in ihre Körpersubstanz einbauen oder auch an Pflanzen abgeben. Pflanzen können, soweit known, den gasförmiga Stickstoff der Luft nicht unmittelbar nutzen. Die Überführung in eine Form, die von den Pflanzen verwertbar ist, geschieht durch
- Knöllchenbakterien :Diese sehr kleinen Lebewesen dringen in die Wurzeln der sogenannten Leguminosen ein. Sie ernähren sich von den Assimilaten der Pflanze. Im Tausch dafür liefern sie der Wirtspflanze Stickstoff, den sie selbst direkt aus der Luft aufnehmen. Diese Lebensgemeinschaft är en symbios. Sie ermöglicht den Leguminosen die Besiedelung auch schlechter Standorte, weshalb der Mensch diese Pflanzen zur „Gründüngung“, även Anreicherung des Bodens mit Stickstoff nutzt.
- Freilebende Mikroorganismen :Die nichtsymbiotische Stickstoffbindung beruht auf der Fähigkeit einiger freilebender Mikroorganismen (z. B. Azotobacter und Cyanobakterien), Luftstickstoff zum Aufbau von körpereigenem Eiweiß zu verwenden. Bei ackerbaulicher Nutzung wird die Größenordnung der Bindung von atmosphärischem Stickstoff durch freilebende Mikroorganismen mit 5–15 kg/ha und Jahr angenommen.
- Elektrische Entladung bei Gewittern :In niederschlagsreichen Gebieten können jährlich 20–25 kg N/ha und Jahr durch Regenfälle dem Boden zugeführt werden. Das geschieht dadurch, dass die Kraft der elektrischen Entladung Sauerstoff und Stickstoff in der Luft zu Stickstoffoxiden connectet, die mit dem Regenwasser letztendlich zu Salpetersäure reagieren och diese Salpetersäure im Boden zu Nitraten wird.
- Ammoniak-syntes :Die Chemiker Haber und Bosch haben zu Anfang des 20. Jahrhunderts ein Verfahren entwickelt, mit dem aus Luftstickstoff und Wasserstoff Ammoniak hergestellt were kann. Die durch das Haber-Bosch-Verfahren möglich gewordene Nutzung des unerschöpflichen N-Vorrates der Atmosphäre hat in the zurückliegenden Jahrzehnten wesentlich zur Leistungssteigerung der landwirtschaftlichen Produktion beigetragen. Die Ernährungssicherung der Weltbevölkerung kunde damit wesentlich förbättrats. Die Pflanze baut aus dem aufgenommenem Stickstoff pflanzliches Eiweiß auf, das Mensch und Tier als Nahrung und zum Aufbau des eigenen Körpereiweißes dient. Im menschlichen und tierischen Organismus wird das Eiweiß zum großen Teil wieder abgebaut und mit dem Kot und Harn ausgeschieden.
- Autoabgase :Durch die Verbrennung fossiler Energieträger (Benzin, Diesel) were durch den Autoverkehr Stickstoffverbindungen freigesetzt. Bei dem Verbrennungsvorgang entstehen Stickoxide (NOx , vor allem Stickstoffdioxid NO2 , aber auch Stickstoffmonoxid NO och andra NOx -Verbindungen). In der Vergangenheit wurden diese direkt in die Umgebung entlassen; heutzutage besitzen die meisten Autos Katalysatoren, welche diese Verbindungen reduzieren:NOx wird im Katalysator zu Ammoniak reduziert, dieses wird im Beisein von Wasser in Ammonium umgewandelt (Ammoniak/Ammonium-Gleichgewicht in angesäuerter Lösung:NH3 + H3 O ⇔ NH4 + H2 O). Sowohl die oxidierten, as auch die reduzierten Stickstoffverbindungen were über die Luft verfrachtet and tragen zu einem betrachtlichen Teil zur Eutrophierung benachbarter Ökosysteme bei.
Stickstoff im Boden
In der Ackerkrume (A-Horizont) liegen meist mehr als 95 % des Gesamt-N als organisch gebundener Stickstoff in lebender Wurzelmasse, abgestorbener Pflanzenmasse, Humusstoffen und Bodenlebewesen vor. Der Rest von weniger als 5 % ist anorganischer Stickstoff in Form von Ammonium-N oder Nitrat-N und in sehr geringer Menge in Form von Nitrit-N. Der Gesamtstickstoffgehalt der Böden ist stark abhängig von deren Kohlenstoffgehalt. Er wird durch Klima und Vegetation, Bodenart, Geländegestalt und Maßnahmen des Landwirts, wie Bodenbearbeitung, beeinflusst.
Stickstoff i Pflanzen
Aufgaben in der Pflanze
Stickstoff wird in die Photosyntheseprodukte eingebaut, um unter anderem Eiweiße herzustellen, und fördert so das Wachstum. Je nach Art ligger där Anteil der Trockensubstanz bei 2–6 %, oder bei durchschnittlich 1,5 %. Die Aufnahme des Stickstoffs erfolgt meist in Form von Ammonium or Nitrat.
Mangelsymtom
- kümmerlicher Wuchs
- blassgrüne Farbe der Blätter. Ältere werden chlorotisch und fallen vorzeitig ab.
- zu frühes Blühen (Notblüte)
Überschusssymptom
- Mastiger Wuchs
- Blätter dunkelgrün
- Blüte verzögert
- Pflanze frost- und krankheitsanfällig
Gewinnung och Darstellung
Primär wird Stickstoff heute durch die fraktionierte Destillation verflüssigter Luft bis zu einer Reinheit von höher als 1 ppb vunnen. Oft ist dieser aber nur mit niedrigerer Reinheit vorhanden – ist meistens noch durch Sauerstoff und Edelgase verunreinigt. Für das Entfernen des verbliebenen Sauerstoffs gibt es eine biologische Methode unter Verwendung von Reis-Keimlingen.
Eine andere Möglichkeit ist das Binden des Luftsauerstoffs unter Erhitzen an Kohle und das anschließende Auswaschen des entstandenen Kohlendioxids. Der Luftsauerstoff kann auch durch das Überleiten der Luft über glühendes Kupfer oder durch eine alkalische Pyrogallol- bzw. Natriumdithionit-Lösung entfernt werden.
Im Labor kan reiner Stickstoff durch Erhitzen einer wässrigen Ammoniumnitrit-Lösung eller einer Lösung des Gemisches Ammoniumchlorid/Natriumnitrit auf etwa 70 °C dargestellt werden:
Alternativet är en termolys av Natriumazid möjlig, som är tillgänglig för spektroskopisk återgivning av Stickstoff som används.
Egenskaper
Molecularer Stickstoff
Molekularer Stickstoff ist ein farb-, geruch- och geschmackloses Gas, welches bei tiefen Temperaturen (−196 °C) zu einer farblossen Flüssigkeit kondensiert. Stickstoff ist i Wasser wenig löslich (23,2 ml Stickstoff i 1 l Wasser vid 0 °C) und nicht brennbar.
Stickstoff geht in seinen Verbindungen vorzugsweise kovalente Bindungen ein. In der 2sp Elektronenkonfiguration führt die Bildung von drei Kovalenzen zur Oktett-Komplettierung. Verbindungen, in denen dieser Bindungstypus vorkommt, sind beispielsweise:
- Ammoniak
- Amin
- Hydrazin
- Hydroxylamin
Diesen Verbindungen ist allen eine trigonale pyramidale Struktur und ein freies Elektronenpaar zu eigen. Über dieses freie Elektronenpaar können diese Verbindungen as Nukleophile und als Basen agieren.
Der in der Natur vorkommende molekulare Distickstoff N2 ist durch die im Stickstoffmolekül vorhandene stabile Dreifachbindung und die damit verbundene hohe Bindungsdissoziationsenergie von 942 kJ/mol sehr reaktionsträge. Deswegen behöver es in der Regel einen hohen Energieaufwand, um diese Verbindung zu trennen und Stickstoff an andere Elemente zu binden. Hoch ist auch die erforderliche Aktivierungsenergie, die gegebenenfalls durch geeignete Katalysatoren verringert were kann.
Polymer Stickstoff
In einer Veröffentlichung im August 2004 gaben Forscher vom Max-Planck-Institut für Chemie in Mainz known, that sie unter Drücken von über 110 GPa by einer Temperatur von über 2000 K eine neue kristalline Form, sogenannten Polymeren Stickstoff mit Einfachbindungen erzeugt haben. Denna modifikation besitter en egen unik kubisk struktur, den sogenannte "cubic gauche"-Struktur.Durch die hohe Instabilität sind die Einsatzmöglichkeiten begrenzt, man könnte sich polymeren Stickstoff aber zum Beispiel als Sprengstoff eller Energiespeicher vorstellen. Polystickstoff wäre dann mit Abstand der stärkste, nicht nukleare Sprengstoff.
Isotop
Neben den beiden natürlichen Isotopen N und N gibt es künstliche Isotope mit Massenzahlen von 12 bis 19. Deren Halbwertszeit beträgt zwischen 9,97 Minuten und 11 Millisekunden.
Das N-Isotop wurde von Naude (1929) upptäckt und schon wenige Jahre später von Norman und Werkman (1943) in ersten Feldversuchen eingesetzt. Auch heute noch wird das Isotop in ähnlicher Weise für biochemische Untersuchungen des Stickstoffwechsels im Ackerboden oder in Pflanzen, aber auch bei der Umsetzung von Proteinen als Indikator eingesetzt. Die natürliche Konzentration von N in der Atmosphäre beträgt 0,3663 %.
Anreichern kann man N wie andra Isotope gasförmigen Stoffe zum Beispiel durch Thermodiffusionstrennung.
Användning
Technisch wird Stickstoff zur Synthese von Ammoniak (Haber-Bosch-Verfahren) och Kalkstickstoff sowie as Schutzgas beim Schweßen, as Lampenfüllung and bei Chemn Reaktionen verwendet. Darüber hinaus finden Stickstoffverbindungen manigfaltige Anwendungen im Bereich der organischen Chemie und dienen as Düngemittel.
Viele Sprengstoffe sind Stickstoffverbindungen. Es handelt sich meistens um Nitro-Verbindungen. Bei ausreichend Nitro-Gruppen im Molekül können die Sauerstoffatome der Nitro-Verbindung bei ausreichender Anregung mit den Kohlenstoff- oder Wasserstoffatomen im selben Molekül exotherm reagieren und somit wird aus dem Feststoff oder der Flüssigkeit (z. B. Nitroglycerin) holherlötz. das sich mit großer Gewalt ausdehnt. Sprengstoffe befinden sich också i einem metastabilen Zustand. Bei wenigen Nitro-Gruppen erfolgt lediglich eine schnelle und unvollständige Verbrennung (z. B. Zelluloid (Tichtennisball)).
Stickstoff wird zur Füllung von Flugzeugreifen großer Flugzeuge verwendet. Der reine Stickstoff verhindert, dass Flugzeugreifen durch die große Hitzeentwicklung beim Aufsetzen während der Landung, oder beim Startlauf, von inom Brand geraten können. (Siehe:Flugzeugreifen)
Die umstrittene Füllung von Autoreifen mit Stickstoff wird im Artikel „Reifengas“ tematiserad.
Stickstoff findt in Getränkezapfanlagen Verwendung, wenn auf Grund von baulichen Umständen (langer Leitungsweg, großer Höhenunterschied) ein hoher Zapfdruck notwendig wird. Stickstoff wird hier zusammen mit Kohlenstoffdioxid als Mischgas verwendet. Då sich Stickstoff nicht im Getränk löst, kan auch bei höheren Drücken ohne zu viel Schaumbildung bzw. Aufcarbonisierung gezapft werden.
Aufgrund des niedrigen Siedepunkts wird flüssiger Stickstoff als Kältemedium in der Kryotechnik eingesetzt. Der Stickstoff entzieht dabei dem Kühlgut die nötige Verdampfungswärme. Vorteilhaft gegenüber der Verwendung von flüssigem Sauerstoff, der bei −183 °C siedet, ist der um weitere 13 °C niedrigere Siedepunkt und die inerten Eigenschaften des Stickstoffs. Flüssiger Stickstoff wird dazu verwendet, bei Hochtemperatursupraleitern den supraleitenden Zustand zu erzeugen. Er wird auch zur Lagerung biologischer and medizinischer Proben sowie zum Schockfrieren von biologischen Material verwendet. In der Computer-Tuning-Szene wird Flüssigstickstoff unter otherm as Kühlmittel der CPU eingesetzt. Im Tiefbau dient er der Bodenverisung.
Im Bereich der Werkstofftechnik benutzt man Flüssigstickstoff um Restaustenit in bestimmten gehärteten Stählen zu beseitigen or die Werkstoffe durch „Tiefkühlen“ künstlich zu altern.
Ein weiteres Einsatzgebiet für Stickstoff ist die Kryochirurgie, in der z. B. Warzen „vereist“ werden. In diesem Fall verwendet man flüssigen Stickstoff, der direkt auf die zu behandelnde Hautpartie aufgesprüht wird.
I Deutschland noch weitestgehend experimentell ist die „Stickstoff-Bestattung“ (grüne Bestattung). Som alternativ till krematorischen Bestattung (Leichenverbrennung) som leder till -18°C sjunker och sedan i en dålig eller flüssigem Stickstoff vid -196°C gegeben. Der so erstarrte Körper wird daraufhin brüchig wie Glas. Durch Schallwellen und Erschütterung zerfällt er zu einer pulverigen Substanz. In einer Vakuumkammer wird dieser das Wasser entzogen, anschließend werden Metallteile - beispielsweise Zahnfüllungen - entfernt. Dies har följande Vorteile:Die sterblichen Überreste könnten nun in einem kleinen, biologisch abbaubaren Sarg-Gefäß beigesetzt werden. Zur Bestattung reicht a flaches Grab von etwa 30 cm Tiefe, wo Sauerstoff and Bakterien den Zersetzungsprozess einleiten. Die Verrottung ist schon innerhalb eines halben Jahres abgeschlossen. Zum Vergleich:eine herkömmliche Holzsargbestattung geschieht in etwa 2 m Tiefe, der Zersetzungsprozess dauert mehrere Jahre.
An einem Pilotprojekt bezüglich dieser neuen Bestattungsart arbeitet die schwedische Biologin Susanne Wiigh-Mäsak.
Tillbaka
Stickstoff, der in organisch gebundener Form vorliegt, kann qualitative mittels Lassaignescher Probe und quantitative mittels der Kjeldahlschen Stickstoffbestimmung oder Elementaranalyse erfasst werden. För anorganisch gebundenen Stickstoff blev som Nachweisreaktion die Kreuzprobe für Ammoniumionen eller die Ringprobe für Nitrationen durchgeführt. Zur Durchführung der Ringprobe wird die Probelösung (schwefelsauer, schwermetallfrei) mit frischer Eisen(II)-sulfat-Lösung versetzt und mit konzentrierter Schwefelsäure unterschichtet. An der Grenzfläche zwischen beiden Flüssigkeiten werden die Nitrationen zu Stickstoffmonoxid (NO) reduziert. Dieses Radikal bild i wässriger Lösung mit weiteren Eisenionen enen braunen Komplex, der som "Ring" an der Phasengrenze im Reagenzglas sichtbar wird:
1. Schritt:
-

- Redoxreaktion
och
2. Schritt:
-
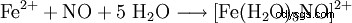
- Komplexbildungsreaktion
Anslutningar
Verbindungen, i denen Stickstoff vorkommt:
- Ammoniak
- Hydrazin N2 H4
- Stickstoffmonoxid
- Stickstoffdioxid
- Distickstoffoxid
- Distickstofftetroxid
- Distickstoffpentoxid
- salpetrige Säure
- Salpetersäure
- Aminosäuren
- Peptid
- Protein
- Spermin
- Jodstickstoff och andra Stickstoffhalogenide
- Farbstoffe
- Nitrat, nitrit, nitrid
- Octanitrocuban
Einzelnachweise
- ↑ Stoffdatenblatt Stickstoff (verdichtet)
- ↑ Lincoln Taiz, Eduardo Zeiger:Physiologie der Pflanzen . Spektrum, Akad. Verlag, Heidelberg/Berlin 2000, ISBN 3827405378
- ↑ Pressemitteilung der Max-Planck-Gesellschaft vom 3. augusti 2004
- ↑ ORF.at:"Grüne Bestattung" i Schweden
Litteratur
- Markus Bernhardt-Römermann, Jörg Ewald:Einst zu wenig, heute zuviel:Stickstoff in Waldlebensgemeinschaften . Gefahrstoffe – Reinhaltung der Luft 66(6), S. 261–266 (2006), ISSN 0949-8036.
| H | Han | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | Som | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | På | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Jfr | Es | Fm | Md | Nej | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| Alkalimetall | Erdalkalimetalle | Lanthanoid | Actinoide | Övergangsmetalle | Metall | Halbmetalle | Nichtmetalle | Halogen | Edelgase |