| kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
| Ingen strukturformel tillgänglig | |||||||
| Allmänt | |||||||
| Namn | Magnesiumoxid | ||||||
| Andra namn | Magnesia | ||||||
| Förhållandeformel | MgO | ||||||
| CAS-nummer | 1309-48-4 | ||||||
| Kort beskrivning | färglösa kristaller | ||||||
| Egenskaper | |||||||
| Molarmassa | 40 g/mol | ||||||
| Sakens tillstånd | fixat | ||||||
| Densitet | 3,65 g cm | ||||||
| Smältpunkt | ~2800 °C | ||||||
| Kokpunkt | ~3600 °C | ||||||
| Löslighet | praktiskt taget olösligt i vatten | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Magnesiumoxid (MgO ) eller Magnesia är ett salt som består av Mg- och O-joner. Det kristalliseras i natriumkloridgittret.Magnesiumoxid framställs genom förbränning av magnesium, den kan erhållas genom utfällning från havsvatten eller den kan framställas genom uppvärmning av en magnesiumförening (t.ex. magnesiumhydroxid Mg(OH)2 ). eller magnesiumkarbonat MgCO3 ).
I det senare fallet beror det kemiska beteendet hos magnesiumoxiden mycket på produktionstemperaturen och produktionsprocessen. När naturligt förekommande magnesiumkarbonat (magnesit) ”bränns” vid cirka 800 °C bildas så kallad ”kaustisk bränd magnesit”. Koldioxid försvinner under bränningsprocessen, men temperaturen är för låg för att tillåta sintring. De resulterande magnesiumoxidkornen har därför fortfarande den yttre formen av magnesiumkarbonat, är porösa och mycket reaktiva på grund av den stora inre ytan. Med vatten bildas magnesiumhydroxid på kort tid. Reaktionen av vissa magnesiumsalter lösta i vatten med kaustikbränd magnesit leder till kristallisering av en stenhård massa. Är magnesiumsaltet magnesiumklorid MgCl2 , man talar om Sorel cement. Detta används för tillverkning av industrigolv. Dessutom används kaustikbränd magnesit i gödsel- och djurfoderindustrin som magnesiumbärare. Magnesiumoxid används också för substitutionsterapi.
Vid 1700 °C till 2000 °C bildas sintrad magnesia, över 2800 °C smält magnesia. Båda sorterna reagerar knappt med vatten. Sintrad magnesia används för ugnsfoder och laboratorieutrustning på grund av dess brandmotstånd (smältpunkt 2800 °C). Magnesia används vid tillverkning av grundläggande eldfasta material för cementproduktion, utvinning av icke-järnmetaller, stålraffinörer och glas, och tillverkning av magnesia-koltegel, det huvudsakliga materialet som används vid tillverkning av eldfasta foder för ståltillverkningskärl (konverterare, ljusbågsugn och skänk). Utan magnesia kan dessa material inte tillverkas med moderna metoder. Detta material användes även tidigare för att isolera rör mellan glödtråden och katoden på elektronrör på grund av dess värmebeständighet.
Magnesiumoxid förekommer naturligt som ett vulkaniskt mineral periklas innan. De är grå till mörkgröna, glasartade, vanliga kristaller med en hårdhet på 5,5 till 6.
Det tillsätts i livsmedel som surhetsreglerande medel eller antiklumpningsmedel. Det är klassificerat som en E 530 livsmedelstillsats i EU utan maxgräns (quantum satis ) allmänt godkänd för livsmedel.
Tillverkning
Det finns flera sätt att producera magnesiumoxid:
Etanolånga (när den värms upp) reagerar med magnesium och bildar magnesiumoxid och etan:
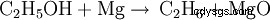
När magnesium brinner i luften reagerar det med syre och bildar magnesiumoxid:
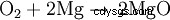
Individuella bevis
- ↑ ChemDat från Merck, Version 2.13.2, 2005
