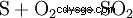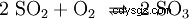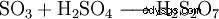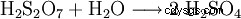| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allmänt | |||||||
| Namn | Svavelsyra | ||||||
| Andra namn | Svavelsyra(VI)syra, vitriololja, dihydrosulfat, monotionsyra | ||||||
| Molekylformel | H2 SO4 | ||||||
| CAS-nummer | 7664-93-9 | ||||||
| Kort beskrivning | färglös och luktfri, lätt trögflytande vätska | ||||||
| Egenskaper | |||||||
| Molarmassa | 98,08 g mol | ||||||
| Sakens tillstånd | flytande | ||||||
| Densitet | 1,8356 g cm | ||||||
| Smältpunkt | 10,38°C | ||||||
| Kokpunkt | 279,6 °C | ||||||
| Ångtryck | 1,3 hPa (145,8 °C) | ||||||
| Löslighet | helt blandbar med vatten | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | 0,1 mg m (mätt som inhalerbar aerosolfraktion) | ||||||
| LD50 | 2140 mg kg (råtta) | ||||||
| WGK | 1 - något farligt för vatten | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Svavelsyra (enligt IUPAC:Dihydrogensulfat ) är en färglös, trögflytande vätska och en stark, oorganisk syra. Det är en av mineralsyrorna och är en av de 20 viktigaste kemikalierna i den kemiska industrin. Som livsmedelstillsats har den numret E 513 .Utspädd svavelsyra kallas utspädd syra. Fram till 1800-talet hade svavelsyra även trivialnamnet vitriololja (som härrör från vitrioler), som inte längre används idag.
Salterna och estrarna av svavelsyra kallas sulfater och vätesulfater. De saltliknande sulfaterna innehåller sulfatjonen (SO4 ).
Erhålla och visa
Förr framställdes svavelsyra med hjälp av vitriolprocessen och blykammareprocessen. Moderna metoder är kontaktmetoden och dubbelkontaktmetoden som utvecklats från den.
Den äldsta processen för framställning av svavelsyra är vitriolprocessen. Det användes av alkemister på 1200-talet. Vitrioler är sulfater som är relativt lätta att termiskt sönderdela för att bilda svaveltrioxid och en metalloxid. Johann Rudolph Glauber (1604–1670) byggde världens första svavelsyrafabrik, som använde denna process för att framställa svavelsyra omkring 1650 i Nordhausen (Harz).
I kontaktprocessen sker produktionen i tre steg, som börjar med elementärt svavel (S) och syre (O2 ) Svaveldioxid (SO2 ) visas:
Svaveldioxiden syresätts ytterligare med vanadinpentoxid (V2 O5 ) som katalysator, till svaveltrioxid (SO3). ) implementerat:
Svaveltrioxid är anhydriden av svavelsyra. På grund av dess låga vattenlöslighet införs den inte direkt i vatten utan i koncentrerad svavelsyra, genom vilken den absorberas mycket väl.
Den bildade svavelsyran späds kontinuerligt med vatten.
Egenskaper
Svavelsyra med molekylformeln H2 SO4 är en stark syra (pKS1 =−3, pKS2 , vilket motsvarar pKS av vätesulfatanjonen HSO4 =1,9). Som en stark oorganisk syra är den en av mineralsyrorna. Koncentrerad svavelsyra är också ett kraftfullt oxidationsmedel. Den är också hygroskopisk och kan därför användas för att torka gaser och vätskor. Den förvrängda tetraedriska svavelsyramolekylen har ett stort dipolmoment, vars positiva pol ligger mellan de två OH-grupperna.
Svavelsyra bildar en azeotrop med vatten. Om 100 % svavelsyra värms upp till koka, avdunstar svaveltrioxid tills en koncentration på cirka 98 viktprocent uppnås. Omvänt kan utspädd svavelsyra bringas till denna koncentration genom att koka den.
100 % svavelsyra framställs genom att svaveltrioxid bubblas in i ca 98 viktprocent svavelsyra tills den är vattenfri. Svavelsyra kan också binda stora mängder svaveltrioxid, den resulterande vätskan kallas oleum på grund av dess höga viskositet. Oleum består av en blandning av svavelsyra och polysvavelsyror (svavelsyra:H2 S2 O7 trisvavelsyra H2 S3 O10 Oleum med upp till 65 viktprocent svaveltrioxid är kommersiellt tillgänglig. Oleum används i kemiska reaktioner för sulfonering eller när det är nödvändigt att binda så mycket vatten som möjligt från reaktionen. Detta minimerar förbrukningen av svavelsyra och maximerar ofta avkastningen.
För att bestämma koncentrationen mäts svavelsyrans densitet. Koncentrationen kan alltså direkt härledas från standardtabeller. Till exempel bestäms laddningstillståndet för ett bilbatteri (se även blybatteri).
Vid spädning av koncentrerad svavelsyra frigörs mycket värme. Därför måste lämpliga försiktighetsåtgärder vidtas. Det är viktigt att alltid syran vattnet är inblandad, dvs inte vattnet av syran ! Annars kan vattnet avdunsta explosivt, vilket gör att vätskan sprutar bort okontrollerat; faran är uppenbar. Mnemoniken:"Först vattnet, sedan syran, annars kommer det monstruösa att hända."
Innebörd och användning
Svavelsyra är en av de vanligaste kemikalierna. 1997 producerades mer än 130 miljoner ton över hela världen. De möjliga tillämpningarna är mycket olika. Svavelsyra används
- för rötning av malmer (t.ex. vid rötning av titan(IV)oxid eller uran)
- för framställning av sulfater
- för produktion av andra syror (t.ex. fluorvätesyra eller fosforsyra)
- för produktion av gödningsmedel via salpetersyra
- för framställning av ytaktiva ämnen
- som en katalysator
- för metallbehandling
- som torkmedel
- som ett reaktionshjälpmedel (nitreringssyra)
- i bilbatterier
- för etsning av halvledare
- på grund av dess ledningsförmåga som tillsats för vatten vid elektrolys
- som lösningsmedel vid rökning
- i analys för att bestämma viskositetstalen för polyamid
- för produktion av titandioxid
Inom livsmedelsindustrin används svavelsyra som en teknisk tillsats för att producera modifierad stärkelse och kasein och för att behandla dricksvatten. Det rinner inte in i slutprodukten och finns därför inte eller endast i spår som är ofarliga för hälsan. I Europeiska unionen behöver inte svavelsyra anges på produktens förpackning.
Att lösa upp kaliumpermanganat i svavelsyra till mättnad ger en mörkgrön oljig vätska (dimanganheptoxid) som är ett starkt oxidationsmedel. Den förkolnar omedelbart organiska material som trä och självantänds med aceton eller andra bränslen. Genom att lösa upp kaliumdikromat i svavelsyra får man kromsvavelsyra, ett ämne som tidigare ofta användes för rengöringsändamål i laboratorier.
Mängden svavelsyra som producerades var en indikator på effektiviteten hos ett lands kemiska industri. Stora mängder svavelsyra förbrukas i den kemiska industrins II utvecklingsfas.
Utvecklingsfaser:
- I. Övervägande konsumtion av kaustiksoda
- II. Övervägande svavelsyrakonsumtion III. rådande klorförbrukning
Struktur och bindning
I svavelsyramolekylen, som i vätesulfatanjonen, har svavelatomen en förvrängd tetraedrisk koordination. De två S-O-bindningarna till OH-grupperna är märkbart längre än till de två "bara" syreatomerna. De påträffade bindningslängderna motsvarar bindningsordningarna 1 och 2. I den ofta använda notationen med (kovalenta) dubbelbindningar och utan formella laddningar kan dock bindningen av de fyra syreatomerna till svavlet inte förklaras utan att använda 3d-orbitalerna för svavlet för π-bindningarna används (jfr PSE). Men detaljerade teoretiska överväganden visar att d-orbitaler bidrar lite till bindning i huvudgruppselementföreningar. Den kortare bindningen till de "bara" syreatomerna beskrivs därför bättre som en kovalent enkelbindning, som förkortas av ytterligare elektrostatiska interaktioner. Laddningsseparationen kan härledas från den enda mesomeriska gränsstrukturen som följer oktettregeln.
Bevis
Svavelsyra kan detekteras i form av sulfatanjonen. Till exempel fungerar utfällning som ett svårlösligt mikrokristallint bariumsulfat efter tillsats av bariumkloridlösning som sulfatdetektion.
Viktiga anslutningar
Salter:
- Kopparsulfat (kopparvitriol)
- Kalciumsulfat (gips, alabaster, anhydrit) (CaSO4 )
- Bariumsulfat (baryt, tung sparre) (BaSO4 )
- Alun (aluminium blandade sulfater med andra katjoner)
- Aluminit
- Järnsulfat (Järnvitriol)
- Natriumsulfat (Glaubersalt)
Estrar:
- dimetylsulfat (lösningsmedel, metyleringsmedel; mycket giftigt)
Källor
- ↑ Post om svavelsyra i GESTIS ämnesdatabasen för BGIA, hämtad den 31 mars 2007 (JavaScript krävs)
- Svavelsyra H2 SO3 (divätesulfit)
- Svavelsyradaggpunkt