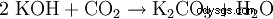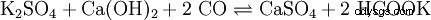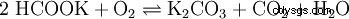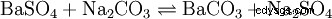| Strukturform | |||||||
|---|---|---|---|---|---|---|---|
| 2 K | |||||||
| Allgemeines | |||||||
| Namn | Kaliumkarbonat | ||||||
| Andra namn |
| ||||||
| Summenformel | K2 CO3 | ||||||
| CAS-nummer | 584-08-7 | ||||||
| Kurzbeskrivning | weißes, kristallines Pulver | ||||||
| Egenskaper | |||||||
| Molare Masse | 138,20 g·mol | ||||||
| Aggregatzustand | fest | ||||||
| Dichte | 2 428 g·cm | ||||||
| Schmelzpunkt | 891 °C | ||||||
| Siedepunkt | Zersetzung | ||||||
| Löslichkeit | sehr gut i Wasser (1120 g/l), unlöslich i Alkohol | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| MAK | keine MAK | ||||||
| WGK | 1 | ||||||
| Soweit möglich and gebräuchlich, were SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Kaliumkarbonat (Pottasche ), K2 CO3 , das Kaliumsalz der Kohlensäure bild ein weißes, hygroskopisches Pulver mit einer Schmelztemperatur von 891 °C und einer Dichte von 2,428 g·cm. Der Name Pottasche stammt von der alten Methode der Anreicherung von Kaliumcarbonat aus Holzasche mittels Lösung der Salze durch Auswaschen mit Wasser und anschließendem Eindampfen in Töpfen (Pötten). Det traditionella namnet står på Pate für den englischen Namn von Kalium:kalium .
Verhalten
I Wasser ist es sehr leicht und gut löslich (1120 g/l). Genom Hydrolyse reagiert die Lösung wegen der Bildung av Kaliumhydroxid alkalisch:
-
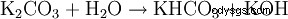 .
. - Kaliumcarbonat reagiert mit Wasser zu Kaliumhydrogencarbonat och Kaliumhydroxid.
Mit Säuren entstehen unter Kohlendioxidentwicklung die entsprechenden Kaliumsalze. Bei Raumtemperatur kristallisiert es als Dihydrat aus der wässrigen Lösung.
Vorkommen
- in einigen Binnengewässern (Totes Meer, Wüste Lop Nor)
- in einigen kleineren Lagerstätten
Vinst
Kaliumcarbonat lässt sich nicht wie Natriumcarbonat nach dem Ammoniak-Soda-Verfahren gewinnen, das Zwischenprodukt Kaliumhydrogencarbonat (KHCO3 ) zu gut löslich ist.
- Karbonisering av Kalilauge:
- Als CO2 -Quelle nutzt man überwiegend Verbrennungsgase.
- Reaktion av Kalkmilch (Calciumhydroxid-Lösung) med Kaliumsulfat och Kohlenmonoxid vid 30 bar (Formiatverfahren). Das abgetrennte Kaliumformiat wird anschließend oxidativ calciniert:
- Auslaugen von Pflanzenasche und anschließendes Eindampfen (historisch, technisch keine Bedeutung mehr)
Användning
- Herstellung von Schmierseifen
- Düngemittel für saure Böden
- Herstellung von Kaligläsern
- Herstellung von Farben
- Herstellung von fotografischen Entwicklern
- wasserfreies Kaliumcarbonat wird im Laborbereich auch als Trocknungsmittel eingesetzt.
- Triebmittel für Flachgebäck („Plätzchen“, särskilt Weihnachtsbäckerei) und Teigen mit hohem Zuckergehalt.
- Behandlung von Kakao
- Neutralisationsmittel bei der Verwendung von Salzsäure (E 507) som 'Aromaverstärker'.
- Schnelltrocknung von Rosinen:Durch Entfernen der natürlichen Wachsschicht der Trauben verdunstet die Feuchtigkeit leichter.
- als Ausgangsprodukt für andra Kaliumverbindungen.
- Zum Entfernen von Asche aus Töpfen (1 Essl. auf die Kruste im Topf geben, über Nacht stehen lassen und am nächsten Tag mit einer Tasse Wasser aufkochen:die Rückstände lösen sich flockig vom Topfboden)
- Trennmittel für Gipsabgüsse (Bildhauerei)
- Elektrolytbestandteil i Schmelzcarbonatbrennstoffzellen
- Zusatzstoff für die Einnahme von bestimmten Suchtmitteln
Soda-Pottasche-Aufschluss
Der Soda-Pottasche-Aufschluss wird für schwerlösliche (Erdalkali-)Sulfate, hochgeglühte (saure or amphotere) Oxid, Silicate and Ag-Halogenide verwendet; der Aufschluss finns i einer Na2 CO3 /K2 CO3 -Schmelze statt. ZrO2 , Zr3 (PO4 )4 , Al2 O3 , Cr2 O3 och Fe2 O3 werden nur teilweise gelöst.Für diesen Schmelzeaufschluss verwendet man Soda und Pottasche im Gemisch, weil damit eine Schmelzpunkterniedrigung gegenüber reinen Salzen zu erhalten ist (eutektische Legierung). Zudem drängt der enorm Carbonatüberschuss das Reaktionsgleichgewicht auf die Produktseite.
Ett spel för sulfat:
Quellen
- ↑ Eintrag zu Kaliumkarbonat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 24.8.2007 (JavaScript erforderlich)