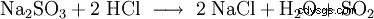| strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allmänt | |||||||
| Namn | Svaveldioxid | ||||||
| Andra namn | Svavel(IV)oxid, svavelsyraanhydrid | ||||||
| Molekylformel | SO2 | ||||||
| CAS-nummer | 7446-09-5 | ||||||
| Kort beskrivning | färglös, stickande, giftig gas | ||||||
| Egenskaper | |||||||
| Molarmassa | 64,06 g mol | ||||||
| Sakens tillstånd | gasformig | ||||||
| Densitet | 2,73 kg m (1 bar, 15°C) | ||||||
| Smältpunkt | −75 °C | ||||||
| Kokpunkt | −10 °C | ||||||
| Ångtryck | 3,3 bar (21°C) | ||||||
| Löslighet | bra (112 g/l ) i vatten | ||||||
| Säkerhetsinstruktioner | |||||||
| |||||||
| MAK | 1,3 mg m | ||||||
| Där det är möjligt och vanligt används SI-enheter. Om inget annat anges gäller de angivna uppgifterna under standardvillkor. | |||||||
Svaveldioxid , SO2 , är anhydriden av svavelsyra H2 SO3 . Svaveldioxid är en färglös, giftig gas med en stickande lukt och sur smak. Det framställs främst vid förbränning av svavelhaltiga fossila bränslen som kol eller petroleumprodukter, som innehåller upp till 4 procent svavel. Som ett resultat bidrar det väsentligt till luftföroreningar, det är orsaken till surt regn, varvid svaveldioxiden först oxideras av syre för att bilda svaveltrioxid och sedan med vatten för att bilda svavelsyra (H2 SO4 ) implementeras. För att förhindra detta finns det olika processer för rökgasavsvavling.
Tillverkning
- genom att bränna svavel eller svavelväte
- genom att rosta sulfidmalmer
t.ex. B. av pyrit:
-

- Järn(II)disulfid och syre reagerar och bildar järn(III)oxid och svaveldioxid.
- från sulfiter av starkare syror
Egenskaper
| E-nummer | 220 |
| kritisk temperatur | 157,5°C |
| kritiskt tryck | 7,9 bar |
En mesomerisk gränsformel för svaveldioxid är följande:
I allmänna termer:
Flytande svaveldioxid löser många ämnen och har därför etablerat sig som ett värdefullt lösningsmedel.
Användning
Svaveldioxid finns i livsmedelsindustrin under namnet E 220 används som konserveringsmedel och antioxidant, speciellt för torkad frukt, potatisrätter, fruktjuice, sylt och vin. Den används också för att producera sulfurylklorid SO2 Cl2 och tionylklorid SOCl2 .
Vidare är svaveldioxid ett viktigt utgångsmaterial för framställning av svaveltrioxid, för att sedan framställa koncentrerad svavelsyra, t.ex. B. med kontaktmetoden.
Svaveldioxid används också vid tillverkning av många kemikalier, mediciner och färgämnen samt vid blekning av papper och textilier.
Föroreningar
I höga koncentrationer skadar SO2 människor, djur och växter. Oxidationsprodukterna resulterar i "surt regn" som äventyrar känsliga ekosystem som skogar och sjöar och angriper byggnader och material.
De totala SO2-utsläppen har minskat kraftigt i de utvecklade industriländerna under de senaste två decennierna genom användning av lågsvavliga eller svavelfria brännbara ämnen och bränslen.
Säkerhetsinstruktioner
En svaveldioxidkoncentration över MAK-värdet kan orsaka huvudvärk, illamående och dåsighet hos människor. I högre koncentrationer skadar gasen allvarligt bronkierna och lungorna eller till och med nukleinsyrorna, bärarna av ärftliga egenskaper.
Källor
- ↑ Materialsäkerhetsdatablad (Praxair)
- ↑ BGIA Gestis databas för farliga ämnen
- ↑ Holleman-Wiberg:Textbook of Inorganic Chemistry 102:a upplagan, de Gruyter, Berlin, 2007.