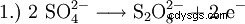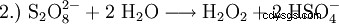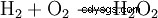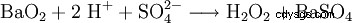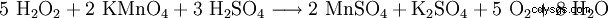| wzór strukturalny | ||||||||
|---|---|---|---|---|---|---|---|---|
| Ogólne | ||||||||
| Nazwa | Nadtlenek wodoru | |||||||
| Inne nazwy | μ-1κO,2κO'-ditlenekdiwodór, perhydrol, nadtlenek wodoru (przestarzały) | |||||||
| Formuła molekularna | H2 O2 | |||||||
| Numer CAS | 7722-84-1 (roztwór wodny) | |||||||
| Krótki opis | bezbarwna ciecz | |||||||
| Właściwości | ||||||||
| Masa molowa | 34,02 g mol | |||||||
| Stan materii | ciecz | |||||||
| Gęstość | 1,45 g cm(20 °C, czysty) 1,11 g cm (20 °C, 30%) | |||||||
| Temperatura topnienia | -0,41 °C (czysty) −33 °C (35%) −11 °C (90%) | |||||||
| Temperatura wrzenia | 150,2 °C (czysto) 108 °C (35%) 142 °C (90%, z rozkładem) | |||||||
| Ciśnienie pary | 1,9 hPa (20°C) | |||||||
| Rozpuszczalność | całkowicie mieszalny z wodą | |||||||
| Instrukcje bezpieczeństwa | ||||||||
| ||||||||
| MAK | 0,5 ml m lub 0,71 mg m | |||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | ||||||||
Nadtlenek wodoru (H2 O2 ) jest jasnoniebieskim, w dużej mierze stabilnym ciekłym związkiem wodoru i tlenu, bezbarwnym w postaci rozcieńczonej. Jest nieco bardziej lepki od wody, jest słabym kwasem i bardzo silnym utleniaczem do większości substancji, który jako taki gwałtownie reaguje z takimi substancjami jak m.in. B. miedź, mosiądz, jodek potasu reaguje i działa jako silny środek wybielający i dezynfekujący. W wysoce skoncentrowanej postaci może być stosowany zarówno jako pojedynczy, jak i komponentowy paliwo rakietowe.
Właściwości fizyczne
H2 O2 - Cząsteczka jest wygięta (kąt dwuścienny =111°). Czysty nadtlenek wodoru jest bardzo lepki ze względu na silne sieciowanie przez wiązania wodorowe. Ponieważ wysoce stężony (=prawie bezwodny) H2 O2 niestabilny i samorzutnie rozkłada się do eksplozji, zwłaszcza w kontakcie z metalami, jest zwykle sprzedawany bez recepty jako maksymalnie 35% roztwór w wodzie. Jednak dla potrzeb przemysłowych istnieją również stężenia 50% H2 O2 w wodzie.
Kontakt z ponad 20% roztworem nadtlenku wodoru może spowodować oparzenia chemiczne. Dlatego podczas obsługi należy nosić rękawice ochronne.
Produkcja
W przeszłości nadtlenek wodoru był wytwarzany głównie przez elektrolizę kwasu siarkowego. Tworzy to kwas nadtlenodwusiarkowy, który jest następnie hydrolizowany z powrotem do kwasu siarkowego i nadtlenku wodoru.
Obecnie nadtlenek wodoru jest produkowany technicznie w procesie antrachinonowym. W tym celu antrahydrochinon poddaje się reakcji z tlenem atmosferycznym pod ciśnieniem, tworząc nadtlenek wodoru i antrachinon. W następnym kroku antrachinon można ponownie zredukować wodorem do antrahydrochinonu itd. Równanie brutto to:
W skali laboratoryjnej nadtlenek wodoru jest również wytwarzany podczas obróbki nadtlenków kwasami. Historycznie ważnym odczynnikiem jest nadtlenek baru, który reaguje w roztworze kwasu siarkowego, tworząc nadtlenek wodoru i siarczan baru.
Molowe entalpie tworzenia to:
- Δf Hgaz :-136,11 kJ/mol
- Δf Hciek :-188 kJ/mol
- Δf Hsol :−200 kJ/mol
Właściwości chemiczne
Nadtlenek wodoru ma tendencję do rozpadu na wodę i tlen. To uwalnia energię 98,02 kJ/mol:
-
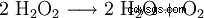
- Dysproporcja dwóch cząsteczek nadtlenku wodoru na wodę i tlen.
Ta reakcja rozkładu jest katalizowana m.in. przez Mn (patrz dowód) lub inne jony metali ciężkich, jony I i OH. Dlatego H2 O2 - Dostępne na rynku roztwory są mieszane ze stabilizatorami (w tym kwasem fosforowym). Jest silnym środkiem utleniającym. Gdy stopień utlenienia zmniejsza się z -I do -II, jako produkty reakcji powstają tylko woda i tlen. Nie ma produktów ubocznych, które są trudne do oddzielenia lub zakłócające, co upraszcza jego użycie w laboratorium.
Może również działać jako środek redukujący wobec silniejszych środków utleniających (np. nadmanganianu potasu).
Nadtlenek wodoru jest bardzo słabym kwasem; jego sole nieorganiczne i estry organiczne to wodoronadtlenki i nadtlenki.
Dowód
Do jakościowego wykrywania jony Mn (np. MnSO4 ) przyznał. Jeśli pojawi się gaz, test tlących się wiórów służy do sprawdzenia obecności tlenu. Jeśli okaże się to pozytywne, ponieważ świecący chip się świeci, H2 było O2 obecny.
- Wykrywanie jako nadtlenek chromu (CrO(O2 )2 )
Zrób z próby festiwalowej. Trójtlenek chromu CrO3 z nadtlenkiem wodoru w zakresie silnie kwaśnym (pH <0) powstaje intensywnie zabarwiony na niebiesko nadtlenek chromu, który rozpuszcza się w eterze. W tym celu użyj dichromianu potasu z rozcieńczonym H2 SO4 zakwasić i przykryć 1 cm eteru (odliczenie!), dodać próbkę i wstrząsnąć. Faza eteru staje się niebieskawa.
- Wykrywanie jako jon peroksoitanylu(IV) ([Ti(O2 )OH])
Detekcja „żółcią tytanową” (nie mylić z barwnikiem o tej samej nazwie) jest bardzo czuła. (Bezbarwne) jony tytanu(IV), nawet ze śladowymi ilościami nadtlenku wodoru, dają intensywnie pomarańczowo-żółty jon peroksoitanylu. I odwrotnie, substancja może być zatem również testowana na zawartość tytanu(IV) za pomocą nadtlenku wodoru.
- Wykrywanie nadmanganianem potasu
Do oznaczania stężenia w roztworach wodnych, m.in. B. kąpiele bielące Oznaczanie wykonuje się oksymetrycznie roztworem nadmanganianu potasu n/10 w roztworze kwasu siarkowego (zmiana na trwałe bladoróżowe zabarwienie (trwające ok. 1 min.) według wzoru:
Fizjologia
Nadtlenek wodoru jest silnie żrący, zwłaszcza jako para. Jeśli dostaniesz się na skórę nadtlenku wodoru, powinieneś dobrze spłukać obszar wodą (rozcieńczenie) lub przynajmniej natychmiast usunąć go ze skóry. Szybko zabija komórki skóry, które następnie stają się białe.
Ogólnie rzecz biorąc, nadtlenek wodoru ma działanie cytotoksyczne, a ze względu na silną toksyczność wobec wielu mikroorganizmów prokariotycznych ma działanie dezynfekujące.
Nadtlenek wodoru powstaje w wielu procesach biochemicznych. W cyklu biologicznym powstaje w wyniku oksydacyjnego metabolizmu cukru. Organizm chroni się przed jego toksycznym działaniem za pomocą enzymów – katalaz, peroksydaz – które przekształcają go z powrotem w nietoksyczny O2 i H2 Rozłóż O.
Po zapłodnieniu przez plemniki żeńska komórka jajowa na krótko wytwarza niskie stężenia nadtlenku wodoru, aby zabić inne plemniki.
Ponadto nadtlenek wodoru jest cząsteczką sygnalizacyjną indukującą obronę rośliny przed patogenami (aspekt cytotoksyczności).
Wykorzystanie
Wybielacz
Nadtlenek wodoru jest środkiem wybielającym, dlatego jest stosowany w kosmetyce do rozjaśniania włosów i wybielania zębów. Jest często używany jako nadtlenek związany z karbamidem.
- Platynowy blond, maksymalne unikanie koloru włosów, ludzkość zawdzięcza nadtlenku wodoru. Niezwykle reaktywny płyn niszczy kolorowe pigmenty we włosach.
Na całym świecie największe zastosowanie można zaobserwować w przyjaznym dla środowiska bieleniu masy celulozowej. Pulpa pozyskiwana jest z drewna i zawartej w nim ligniny z H2 O2 bielone. Głównym zastosowaniem pulpy jest produkcja papieru, serwet, chusteczek do nosa itp.
W rękodziele nadtlenek wodoru wykorzystywany jest do wybielania – czyli rozjaśniania – drewna, m.in. B. podczas renowacji lub renowacji.
Nadtlenek wodoru lub środki wybielające zawierające nadtlenek wodoru, takie jak mieszanina kwasu nadoctowego i nadtlenku wodoru, są również używane w reklamie ze sztucznym słowem aktywny tlen. dzwoniono.
Dezynfekcja i sterylizacja
Do dezynfekcji stosuje się nadtlenek wodoru w postaci trzyprocentowego roztworu w jamie ustnej i gardle, np. B. w stomatologii; służy również do dezynfekcji soczewek kontaktowych w środkach do czyszczenia soczewek oraz do sterylizacji materiałów opakowaniowych, a także do dezynfekcji rąk. Jest również stosowany w kremach do skóry twarzy w celu otwarcia porów i zwalczania wyprysków i wyprysków. Jest często używany do oczyszczania ścieków przemysłowych i dezynfekcji wody w basenach.
W przemyśle spożywczym 30% nadtlenek wodoru jest stosowany w systemach aseptycznego napełniania do sterylizacji butelek PET Wiele produktów spożywczych (napoje, mleko, nabiał, sosy, zupy itp.) pakuje się aseptycznie w kartony, kubki, butelki i folie w celu poprawy trwałość i jakość produktu . Najczęściej stosowanym procesem jest sterylizacja stężonym nadtlenkiem wodoru (35%). Silne działanie bakteriobójcze H2 O2 , kompatybilność środowiskowa i dobra wykonalność techniczna są powodami powszechnego stosowania tego procesu. W praktyce operacyjnej rozróżnia się proces natryskiwania i kąpieli zanurzeniowej.
Dostarczanie tlenu
Nadtlenek wodoru może być stosowany w akwariach do dostarczania tlenu. Tlen jest generowany w utleniaczu. W tym celu nadtlenek wodoru jest rozbijany na rodniki wodne i tlenowe w zbiorniku w akwarium za pomocą katalizatora.
Korzystanie z kilku efektów jednocześnie
Podczas renowacji wnętrz nadtlenek wodoru może być stosowany do zwalczania pleśni. Jako środek dezynfekujący może zarówno zabijać biologicznie aktywne komórki (środek grzybobójczy), jak i niszczyć zarodniki (sporycyd). Również nie może być używany jako wybielacz Usunięte pozostałości pokrycia - na białej porowatej powierzchni - "optycznie nieszkodliwe". Nadtlenek wodoru jest lepszy niż alkohol lub podchloryn sodu, ponieważ substancje te są produktami ubocznymi, takimi jak B. sole w podłożu mogą wytwarzać. Alkohol nie jest ani sporobójczy, ani wybielający w porównaniu z nadtlenkiem wodoru.
Nadtlenek wodoru jest również używany do wybielania i dezynfekcji przy preparowaniu kości. W stomatologii H2 O2 służy do miejscowej dezynfekcji tkanek zęba i zatrzymywania krwawienia podczas drobnych zabiegów.
W rolnictwie nadtlenek wodoru jest używany do dezynfekcji szklarni i do natleniania hydroponicznych pożywek hodowlanych.
Biologia
Aby określić kultury bakteryjne, test katalazy przeprowadza się z 3% roztworem nadtlenku wodoru. Większość bakterii tlenowych i fakultatywnie beztlenowych, a także grzybów, posiada enzym katalazę, który jest zdolny do rozkładania toksycznego dla komórek H2 O2 podzielić.
Nadtlenek wodoru może być stosowany w kryminalistyce do wykrywania krwi. W 1818 Louis Jacques Thenard odkrył, że peroksydaza w hemoglobinie rozkłada nadtlenek wodoru. Christian Friedrich Schönbein opracował na tej podstawie badanie krwi w 1863 roku. Dziś jednak do wykrywania krwi stosuje się bardziej czuły test Kastle-Meyera.
Eksperymentalnie nadtlenek wodoru jest używany w biologii do indukowania zaprogramowanej śmierci komórki w izolowanych komórkach eukariotycznych.
Kaustyka
W mikroelektronice mieszanina kwasu siarkowego i nadtlenku wodoru – zwana „pirania” – służy do czyszczenia powierzchni wafli i wytwarzania cienkiej, hydrofilowej warstwy tlenku o grubości około 3-4 nm. Obecnie bardziej powszechny jest termin „SPM” (mieszanina nadtlenku siarki). Głównym zastosowaniem jest usuwanie fotorezystów.
W produkcji płytek drukowanych (PCB) do usuwania miedzi stosuje się kąpiele trawiące chlorek miedzi:
-
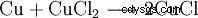 .
. - Elementarna miedź reaguje z chlorkiem miedzi(II) tworząc chlorek miedzi(I). To jest proporcja.
Nadtlenek wodoru jest używany razem z kwasem solnym do regeneracji kąpieli trawiących chlorkiem miedzi:
-
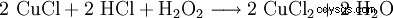 .
. - Chlorek miedzi(II) regeneruje się w reakcji chlorku miedzi(I) z nadtlenkiem wodoru i kwasem chlorowodorowym. Atom miedzi jest utleniony.
Dodatek nadtlenku wodoru i kwasu solnego jest kontrolowany przez potencjał redoks.
Silniki rakietowe/torpedowe
Jako dostawca energii i tlenu (m.in. rozkład przez dwutlenek manganu) był używany w postaci skoncentrowanej w napędach rakietowych (np. Max Valier, Messerschmitt Me 163) i okrętach podwodnych (Walter U-Boot). Nadtlenek wodoru, rozłożony za pomocą nadmanganianu potasu, był również używany jako paliwo do pomp paliwowych (500 KM) A4. Nierozłożony nadtlenek wodoru był używany jako nośnik tlenu, ciekły w normalnej temperaturze, w brytyjskich rakietach (np. Black Arrow) i spalany tam z naftą.
Nadtlenek wodoru ma tendencję do niekontrolowanego rozkładu. Zmarł więc 16 lipca 1934 r. Dr. Kurt Wahmke i dwóch techników w Kummersdorfie podczas eksplozji silnika napędzanego nadtlenkiem wodoru. Ze względu na niebezpieczeństwo podczas użytkowania i obsługi (efekt korozyjny, niekontrolowany rozkład, wybuch w przypadku zanieczyszczenia zbiornika i instalacji rurowej), zastosowanie jest teraz ograniczone do małych silników rakietowych (próby bicia rekordu, silniki sterujące).
Zatonięcie rosyjskiej atomowej łodzi podwodnej Kursk podobno w 2000 roku było to spowodowane wyciekiem wody utlenionej ze zbiornika w torpedzie, a następnie reagowaniem z miedzianymi częściami, powodując pęknięcie torpedy.
Produkcja materiałów wybuchowych
W obecności odpowiedniego katalizatora nadtlenek wodoru reaguje z acetonem tworząc nadtlenek acetonu. Nadtlenek acetonu jest materiałem wybuchowym, ale nie jest używany komercyjnie, ponieważ jest bardzo niebezpieczny w obsłudze. Dokładniej, nadtlenek acetonu jest również określany jako trinadtlenek triacetonu, w skrócie TATP. Inne materiały wybuchowe wytworzone z nadtlenkiem wodoru obejmują heksametylenotrinadtlenek diaminy (HMTD).
Według ekspertów z Instytutu Technologii Chemicznej im. Fraunhofera, TATP jest wykorzystywany w większości zamachów samobójczych w Izraelu. Mówi się, że ataki z 7 lipca 2005 r. na londyńskie metro (55 zabitych) były również popełnione przez TATP. Wreszcie 4 września 2007 r. aresztowano trzech islamistów wyszkolonych w Pakistanie w Oberschledorn w Sauerland, którzy chcieli wyprodukować TATP z 730 kilogramów 35% roztworu nadtlenku wodoru w celu zaatakowania amerykańskich obiektów i restauracji w Niemczech odwiedzanych przez obywateli USA.
Z drugiej strony eksperci nie wiedzą szczegółowo, w jaki sposób terroryści mogliby w kontrolowany sposób zdetonować TATP wytworzony z nadtlenku wodoru. W szczególności podczas udaremnionej próby przemytu płynnych materiałów wybuchowych do samolotu w Londynie w 2007 r. zakwestionowano możliwość wyprodukowania odpowiedniego nadtlenku acetonu na pokładzie przy użyciu przemycanych butelek z nadtlenkiem wodoru i acetonem.
Referencje
- Werner R. Thiel:Nowe drogi do nadtlenku wodoru:alternatywy dla ustalonych procesów? Angewandte Chemie 111(21), s. 3349-3351 (1999)
- Heribert Offermanns, Gunther Dittrich, Norbert Steiner:Nadtlenek wodoru w ochronie i syntezie środowiska . Chemia naszych czasów 34(3), s. 150–159 (2000), ISSN 0009-2851
Referencje
- ↑ Wpis dotyczący Nadtlenku wodoru w bazie danych substancji GESTIS BGIA, pobranej dnia 16.11.2007 (wymagany JavaScript)
- ↑ Süddeutsche Zeitung z 6 września 2007, s. 2:„Aktualna encyklopedia:nadtlenek wodoru “. Podpisano:mkf
- ↑ Informacje zawarte w tym akapicie są oparte na mkf podpisany artykuł „Aktualna encyklopedia:Nadtlenek wodoru “ na stronie 2 Süddeutsche Zeitung od 6.9.2007.
- ↑ Süddeutsche Zeitung z 6 września 2007, s. 1f.
- ↑ netzeitung.de
- ↑ Rundschau-online.de
- ↑ Ten akapit odnosi się do oraclesyndicate – Karla Weissa i artykułu Wikipedii o nadtlenku acetonu.