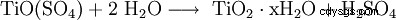| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Brak dostępnej formuły strukturalnej | |||||||
| Ogólne | |||||||
| Nazwa | Tlenek tytanu(IV) | ||||||
| Inne nazwy |
| ||||||
| Formuła molekularna | O2 Ti | ||||||
| Numer CAS | 13463-67-7 | ||||||
| Krótki opis | biały krystaliczny proszek | ||||||
| Właściwości | |||||||
| Masa molowa | 79,90 g mol | ||||||
| Stan materii | naprawiono | ||||||
| Gęstość | 4,24 g cm | ||||||
| Temperatura topnienia | 1855°C | ||||||
| Temperatura wrzenia | 2900°C | ||||||
| Rozpuszczalność | zły w kwasie fluorowodorowym, stężonym kwasie azotowym i siarkowym, nierozpuszczalny w wodzie, kwasie solnym, rozcieńczonym kwasie azotowym i siarkowym | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| Właściwości termodynamiczne | |||||||
| ΔHf | -249 kJ/mol (rutyl) | ||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
Tlenek tytanu(IV) (Dwutlenek tytanu ) jest jednym z tlenków tytanu.
Zdarzenia
Tlenek tytanu(IV) występuje naturalnie w trzech odmianach:
- Rutyl jest minerałem czworokątnym o przeważnie pryzmatycznym pokroju. Nazwa rutyl pochodzi od łacińskiego rutilus – czerwonawy. Rutyl ma gęstość 4,26 g/cm. Jest szczególnie popularny jako biały pigment.
- Anataz tworzy tetragonalne holoedryczne kryształy (holoedryczny oznacza najbardziej symetryczną grupę w układzie krystalicznym, w tetragonalnym, czyli 4/m 2/m 2/m). Anataz stopniowo (szybciej od temperatury ponad 700 °C) nieodwracalnie przekształca się w rutyl. Gęstość anatazu wynosi 3,88 g/cm. Anatase służy również jako biały pigment.
- Brookit tworzy minerały rombowe i nie służy jako biały pigment. Brookite również zamienia się w rutyl poniżej temperatury topnienia.
Ponieważ złoża naturalne mają niepokojące kolory, które z. B. przez żelazo w ilmenicie (FeTiO3 ) są spowodowane, są one rafinowane w procesie siarczanowym lub chlorkowym (preferowane).
Uzyskiwanie i wyświetlanie
Przez solwolizę (hydrolizę) związku Ti(IV):
Właściwości
Temperatura topnienia dwutlenku tytanu wynosi 1855 °C. Jest stabilny termicznie, trwały, ma wysoki współczynnik załamania światła (2,8), a co za tym idzie świetnie koloryzuje i kryje. Dwutlenek tytanu jest chemicznie bardzo obojętny. Jest odporny na światło, niedrogi, całkowicie nietoksyczny i dlatego jest najważniejszym białym pigmentem.
Wykorzystanie
Jako biały barwnik stosuje się dwutlenek tytanu. Została odkryta w Norwegii i USA w 1908 roku i produkowana tam od 1909 pod nazwą Kronos Titanium White. Produkcja rozpoczęła się w Niemczech w 1924 roku pod nazwą Degea-Titanweiss. Biel tytanowa była produkowana tylko w formie anatazu do 1938 roku, ale potem głównie w formie rutylowej, która okazała się bardziej stabilna wobec środków wiążących olej i barwników organicznych. Dlatego był również określany jako biały rutylowy.
Biel tytanowa ma najwyższą nieprzezroczystość spośród wszystkich białych pigmentów i doskonałą zdolność rozjaśniania. Jest stabilny chemicznie, nietoksyczny i można go znaleźć pod oznaczeniem E 171 jako dodatek do żywności, na przykład w pastach do zębów i kroplach na kaszel. Jest również czasami używany w malarstwie olejnym. W dziedzinie technicznej jest stosowany w farbach i lakierach (np. do farb ściennych i tekstyliów), w papierze oraz jako bloker UV w kremach przeciwsłonecznych i rozjaśniaczach w lekach (tabletkach). Efekt fotokatalityczny TiO2 Nanocząstki stosuje się w związku z działaniem UV do „samoczyszczenia” powierzchni (fotokatalityczne samooczyszczanie). Barwne ogniwo słoneczne (ogniwo Grätzla) ponownie bazuje na półprzewodnikowych właściwościach dwutlenku tytanu. Dwutlenek tytanu jest również używany jako główny składnik dielektryka ceramicznego w kondensatorach ceramicznych klasy 1.
Dwutlenek tytanu w modyfikacji anatazu jest głównym składnikiem katalizatorów stosowanych do przemysłowego odazotowania spalin z wykorzystaniem procesu SCR.
Produkcja tlenku tytanu w procesie siarczanowym wytwarza rozcieńczony kwas (rozcieńczony kwas siarkowy), którego część jest ponownie wykorzystywana do produkcji tlenku tytanu poprzez koncentrację. W niektórych krajach część tego rozcieńczonego kwasu jest nadal odprowadzana do rzek i mórz lub wyrzucana, natomiast proces chlorowania nie wytwarza rozcieńczonego kwasu. Stosowany chlor pozostaje w dużej mierze w cyklu procesu.
TiO2 jest również stosowany w dziedzinie wykańczania płytek, co oznacza, że powierzchnie obrobionych płytek stają się odporne na zabrudzenia.
Dowód
Świeżo wytrącony na zimno dwutlenek tytanu jest amfoteryczny i rozpuszczalny w rozcieńczonych kwasach mineralnych. Trawienie odbywa się za pomocą wodorosiarczanu potasu w porcelanowym tyglu. Następnie rozpuszcza się w zimnej wodzie z niewielką ilością kwasu siarkowego. Z kilkoma kroplami nadtlenku wodoru, żółty (podstawowy) do żółto-pomarańczowego (kwaśny, zdjęcie) [Ti(O2 ) kation wodny Kwas solny i cynk (granulki) tworzą wodór, który przekształca Ti(IV) w czerwono-fioletowy [Ti(H2 O)6 ] zmniejszona.
Nanotechnologia
Indywidualne dowody
- ↑ Wpis dotyczący tlenku tytanu(IV) w bazie danych substancji GESTIS BGIA, pobranej 29 listopada 2007 r. (wymagany JavaScript)
- ↑ Susanne Donner:Sprzątanie mocą światła . Technology Review, nr 7, lipiec 2006, s. 19 i nast.