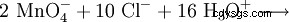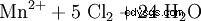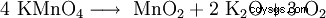| wzór strukturalny | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ogólne | |||||||||
| Nazwa | Nadmanganian potasu | ||||||||
| Inne nazwy | Tetraoksomanganian(VII) potasu, manganian(VII) potasu, nadmanganian(um) potasu | ||||||||
| Formuła molekularna | KMnO4 | ||||||||
| Numer CAS | 7722-64-7 | ||||||||
| Krótki opis | ciemnofioletowe kryształy z metalicznym połyskiem | ||||||||
| Właściwości | |||||||||
| Masa molowa | 158,03 g mol | ||||||||
| Stan materii | naprawiono | ||||||||
| Gęstość | 2,70 g cm | ||||||||
| Temperatura topnienia | Rozkład powyżej 240 °C | ||||||||
| Temperatura wrzenia | Nie dotyczy | ||||||||
| Ciśnienie pary | 0,01 mbar (przy 20 °C) | ||||||||
| Rozpuszczalność | umiarkowany w wodzie (64 g/l przy 20 °C) | ||||||||
| Instrukcje bezpieczeństwa | |||||||||
| |||||||||
| MAK | 0,5 mg m | ||||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||||
Nadmanganian potasu (KMnO4 ) to sól potasowa kwasu nadmanganowego, HMnO4, która w stanie wolnym jest nieznana . Jest to krystaliczne ciało stałe o głębokim czerwono-fioletowym metalicznym połysku i silny utleniacz. Za intensywny kolor soli odpowiada wyłącznie anion nadmanganianowy. Wynika to z tworzenia kompleksu przeniesienia ładunku. W nadmanganianach mangan jest na najwyższym stopniu utlenienia, VII.
Właściwości
Nadmanganian potasu tworzy ciemnoczerwono-fioletowe błyszczące kryształy, które są umiarkowanie rozpuszczalne w wodzie i nawet w niskich stężeniach dają intensywnie fioletowy roztwór. Po podgrzaniu kryształy nie topią się, lecz rozpadają się z wyraźnym trzaskiem, uwalniając tlen. Krystaliczny nadmanganian potasu jest stabilny w temperaturze pokojowej, ale jego wodne roztwory z czasem ulegają degradacji.
Ponieważ mangan jest obecny na najwyższym stopniu utlenienia w anionie nadmanganianowym, występuje jako bardzo silny środek utleniający w reakcjach redoks. Na przykład nadmanganian potasu utlenia kwas solny do gazowego chloru (laboratoryjna metoda przygotowania chloru):
Ponadto utlenia np. siarczyny do siarczanów, jony Fe(II) do Fe(III), alkohole do kwasów karboksylowych. Może również powodować rozkład [[Chemia organiczna|organicznych] substancji. Nadmanganian potasu utlenia się.
Nadmanganian potasu rozkłada się z 240 °C do dwutlenku manganu (MnO2 ), tlenek potasu (K2 O) i tlen (O2 ):
Jako kompleks z eterami koronowymi nadmanganian potasu może być również dostępny w niepolarnych rozpuszczalnikach organicznych, takich jak benzen lub toluen, które są wykorzystywane w syntetycznej chemii organicznej.
Produkcja
Produkcja techniczna zaczyna się od dwutlenku manganu MnO2 z wodorotlenkiem potasu i tlenem atmosferycznym, tworząc zielony manganian(VI) potasu K2 MnO4 zareagował. Jest on dalej przetwarzany elektrochemicznie w celu wytworzenia nadmanganianu potasu (utlenianie anodowe) i jest sprzedawany w postaci krystalicznej.
Wykorzystanie
Ze względu na silne działanie utleniające nadmanganian potasu jest stosowany m.in. jako środek dezynfekujący, dezodorant i algicyd. W ilościowej analizie chemicznej (oksydymetria, manganometria, miareczkowanie redoks) służy do oznaczania dużej liczby substancji (np. żelaza, azotynów, szczawianów, a pośrednio także wapnia); tutaj punkt końcowy oznaczania jest oznaczony kolorem fioletowym. W laboratorium do mycia naczyń szklanych stosuje się również alkaliczny roztwór nadmanganianu potasu. W fotografii służy do wykrywania soli utrwalającej (tiosiarczan sodu) i do redukcji prześwietlonych zdjęć; to utlenia srebro.
Gdy gliceryna zostanie wrzucona na nadmiar soli, mieszanina zapala się po kilku sekundach do minut i pali charakterystycznym fioletowym płomieniem. Ta opóźniona reakcja została wykorzystana do rozpoczęcia reakcji termitu z powodu intensywnego ciepła.
Medycyna
W medycynie roztwór nadmanganianu potasu stosowany jest jako środek ściągający i dezynfekujący do zewnętrznego leczenia skóry m.in. na grzybicę stóp lub pieluszkę (kod ATC D08AX06). W Toksykologii Ratunkowej, bordowy Roztwór nadmanganianu potasu (ok. 0,1%) służy do płukania żołądka w przypadku zatrucia po spożyciu toksyn ulegających utlenieniu.
Historyczne
Fotografowie z przeszłości stosowali nadmanganian potasu jako składnik proszków błyskowych. Nadmanganian potasu był używany do płukania gardła, a podczas gotowania dezodoryzował nieświeże mięso i przywracał je do spożycia.
Instrukcje bezpieczeństwa
Nadmanganian potasu ma 3 klasę zagrożenia wody (wysoce niebezpieczny dla wody), który oprócz działania utleniającego należy uwzględnić przy usuwaniu pozostałości nadmanganianu. Nadmanganian potasu ma niską toksyczność ostrą (LD50 (szczur, doustnie) =750 mg/kg), ale ma silne działanie drażniące na żywą tkankę ze względu na silne działanie utleniające, dzięki czemu łatwo dochodzi do oparzeń chemicznych. Dlatego należy unikać wszelkich kontaktów innych niż zastosowanie medyczne lub nawet przyjmowanie doustne! Pył nadmanganianu powoduje zmętnienie rogówki.
Samo przebarwienie skóry, które pojawia się w kontakcie, jest jednak nieszkodliwe i spowodowane jest dwutlenkiem manganu powstającym podczas redukcji nadmanganianu. Większe przebarwione obszary można ponownie wybielić roztworami siarczynów.
W wyniku silnego działania utleniającego nadmanganian potasu gwałtownie reaguje z wieloma substancjami redukującymi lub palnymi i może dojść do samozapłonu. Mieszaniny z takimi substancjami, które nie prowadzą do spontanicznej reakcji, są wyjątkowo łatwopalne i mogą wtedy reagować wybuchowo.