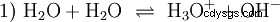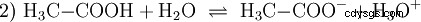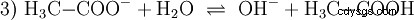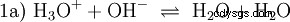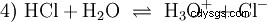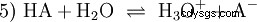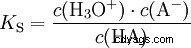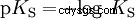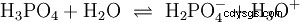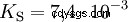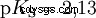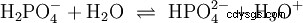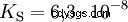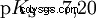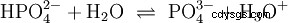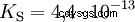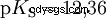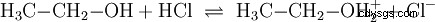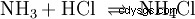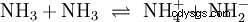kwasy to w węższym znaczeniu wszystkie związki, które są w stanie przenosić protony (H) na partnera reakcji - mogą pełnić rolę donoru protonów. W roztworze wodnym reagentem jest zasadniczo woda. Jony oksoniowe (H3 O), pH roztworu jest w ten sposób obniżone. Kwasy reagują z tzw. zasadami tworząc wodę i sole. Zasada jest zatem przeciwieństwem kwasu i jest w stanie go zneutralizować.
W szerszym sensie, różne koncepcje kwasowo-zasadowe opisują znacznie szersze zestawy reakcji chemicznych, które mogą wykraczać daleko poza reakcje wymienione powyżej.
Historyczny rozwój kwasów
Prawdopodobnie najstarszy znany kwas (łac. acidum ) to ocet (łac. acetum ), około 5% wodny roztwór związku kwasu octowego. Kwasy były czymś podobnym do octu (oksy lub kwas ). W alchemii kwas był uważany za pierwotną substancję . Właściwości kwasowe oparto na pojedynczym kwasie moczowym , które weszły w życie w różnych substancjach. Kwasy powodują pienienie się wapna lub węglanów, działają żrąco i palą. Poza octem i innymi sokami roślinnymi do końca XIII wieku nie były znane żadne kwasy. Rozszerzoną wiedzę o kwasach przypisywano Geberowi żyjącemu w VIII wieku, ale opiera się ona na pismach znacznie młodszego, tak zwanego pseudo-Gebera. [1]. Rozwinęła się wiedza na temat różnych kwasów nieorganicznych, z których wszystkie są odmianami pierwiastka woda zostały przypisane. Od XVIII wieku nazywano je kwasami mineralnymi.
- Produkcja kwasu azotowego (HNO3 ) był prawdopodobnie używany przez pseudoofiarodawców po XIII wieku do rozpuszczania wody (aqua dissolutiva ) lub silna woda (aqua fortis ) opisane. Witriol miedziany został podgrzany do czerwoności za pomocą saletry i ałunu. Ulatniają się gazy azotowe, które z wodą tworzą kwas azotowy. Ten kwas był również nazywany oddzielaniem wody , ponieważ rozpuszcza srebro w reakcji chemicznej, ale nie złoto. W 1648 J. R. Glauber opisał produkcję stężonego (dymiącego) kwasu azotowego (spiritus acidus nitri). ) w reakcji z kwasem siarkowym.
- Aqua regia, z dzisiejszego punktu widzenia mieszanina kwasu azotowego i chlorowodorowego, była prawdopodobnie znana od dawna, ponieważ można ją stosunkowo łatwo otrzymać w reakcji kwasu azotowego z dobrze znanym amoniakiem sali. Aqua regia była królową wszystkich kwasów , nawet złota, król metali , mógł się oprzeć.
- Kwas siarkawy (H2 SO3 ) jest z pewnością znana od dawna, ponieważ można ją uzyskać poprzez spalanie siarki elementarnej. Kwas siarkowy z pewnością był również obecny w wielu procesach. Bardziej szczegółowe procesy przygotowania kwasu siarkowego (H2 SO4 ) po raz pierwszy bardziej szczegółowo opisał A. Libavius w 1597 r.:a) wyżarzanie siarczanu żelaza lub miedzi z witriolami (Oleum vitrioli , dymiący kwas siarkowy) i b) spalanie siarki, a następnie utlenianie, w wyniku którego powstają rozcieńczone roztwory (Oleum sulphuris ) doprowadziło. W XIX wieku udało się zrealizować techniczne wdrożenie w procesie komory ołowianej.
- Kwas solny (HCl) jako niezależny związek stał się znany dopiero pod koniec XVI wieku. A. Libavius opisał syntezę poprzez zapalenie mieszaniny soli kuchennej i gliny. B. Valentinus opisał przemianę witriolu i soli kuchennej w aqua caustica , żrąca woda. Intensywne badania J. R. Glaubera w XVII wieku doprowadziły do \u200b\u200bsolnego ducha Glaubera (Spiritus salis Faithrianus ) bardzo skoncentrowanego, tzw. palenia kwas solny lub gazowy chlorowodór.
Ważny termin baza jako fenomenologiczny odpowiednik kwasów był używany w XVII wieku przez alchemików, takich jak G.E. Stahl, R. Boyle i GF Rouelle, ponieważ „podstawowe” substancje mają nielotność. Podstawa wiązania lotnych kwasów tworzą się i mogą neutralizować (korozyjne) działanie kwasów. A. L. Lavoisier, który przypisał pewne właściwości pewnym związkom chemicznym, dokonał w XVIII wieku fundamentalnych kroków w chemii. Uważał, że kwasy zawsze powstają z tlenków niemetali i wody, a zasady z tlenków metali i wody. Z drugiej strony J. von Liebig widział kwasy jako związki wodorowe, które metale mogą przekształcić w sole.
W 1887 r. S. Arrhenius zdefiniował kwasy jako substancje, które po rozpuszczeniu w wodzie uwalniają protony (H), a zasady jako substancje, które po rozpuszczeniu w wodzie uwalniają jony wodorotlenkowe (OH). Kiedy kwasy i zasady są połączone, neutralizują się, tworząc wodę. Jednak teoria była wciąż niewystarczająca, ponieważ nie uwzględniono związków bez tlenu:amoniak neutralizuje również kwas. W 1923 r. J. N. Brønsted i T. Lowry niezależnie opisali to, co do dziś jest najważniejszą definicją kwasów i zasad. Stanowią one podstawę poniższych wyjaśnień dotyczących kwasów.
Właściwości kwasów
- Kwasy szczególnie atakują metale nieszlachetne i wapno. Ale odzież, skóra i oczy (ogólnie wszystkie materiały organiczne) są również zagrożone w przypadku kontaktu. Ostrożność! Oparzenia chemiczne zawsze mogą się zdarzyć. Nosić okulary ochronne!
- Istnieją mocne i słabe kwasy. Kwas solny jest mocnym kwasem. Kwas octowy jest kwasem słabszym, a kwas węglowy jest kwasem słabym.
- Kwasy można rozcieńczyć wodą, ale ich działanie jest znacznie słabsze w zależności od rozcieńczenia. Rozcieńczanie stężonych kwasów jest reakcją egzotermiczną. Wytwarzane jest dużo ciepła i roztwór kwasu może wytrysnąć w niekontrolowany sposób. Dlatego przy rozcieńczaniu obowiązuje zasada dodawania kwasu do wody, a nie na odwrót:„Najpierw woda, potem kwas, w przeciwnym razie stanie się coś potwornego. „
- To powszechna nieprawda, że kwasy są zawsze płynami. Dobrze znanymi przedstawicielami kwasów występujących wyłącznie w postaci stałej są witamina C i kwas cytrynowy.
- Kwasy zmieniają kolor niebieski papierek lakmusowy na czerwony.
- „Przeciwnikami kwasów” są zasady (roztwór zasad =ług). Mogą neutralizować kwasy. Zasady są również żrące i atakują wiele innych substancji, które niekoniecznie reagują z kwasami.
- Kwasy rozpuszczone w wodzie przewodzą prąd. Tutaj zachodzi elektroliza, w której na katodzie (biegunie -) powstaje wodór, a na anodzie (biegun +) zobojętniona substancja jonu reszty kwasowej (anion kwasowy), np. chlor w przypadku kwas chlorowodorowy. Redukcja (akceptacja elektronów) zachodzi na katodzie, a utlenianie (utrata elektronów) następuje na anodzie.
Co to są kwasy?
Bez zagłębiania się w różne koncepcje kwasowo-zasadowe na wstępie należy opisać możliwy i powszechny sposób patrzenia na rzeczy. zazwyczaj jest blisko spokrewniony z kwasami i często bez wyraźnej wzmianki obecność i pewne właściwości wody. Czysta woda podlega tzw. autoprotolizie. Jony oksoniowe (H3) powstają z wody w bardzo małych i równych ilościach O) i jony wodorotlenowe (OH):
To równanie reakcji wody pokazuje właściwość kwasu, a mianowicie zdolność do tworzenia H3 Jony O w wodzie. Jednocześnie w wodzie powstają jony OH. Jedna z cech, jakie może mieć baza. Jednak woda nie jest ani zasadą, ani kwasem, a ich zachowanie jest określane jako neutralne . Odnosi się to do pH, czyli stężenia H3 oznacza jony O w wodzie. Czysta woda ma pH 7, bardzo małe stężenie. Podobnie jak wszystkie reakcje opisane w tej sekcji, ta reakcja jest reakcją równowagi:tworzenie się jonów i ich łączenie w wodę odbywa się w sposób ciągły iz tą samą częstotliwością. Neutralny nie oznacza, że nic się nie dzieje.
Kwasy to związki chemiczne, które mogą w określony sposób oddziaływać z wodą. Posiadają atomy wodoru połączone jak jony (jonogenne). W ten sposób czysty kwas octowy (H3 C-COOH) z wodą i tworzy więcej H3 Jony O. Gdy zachodzi taka reakcja, związek można nazwać kwasem. Oprócz jonu oksoniowego powstaje również anion octanowy H3 K-COO:
Kwas octowy jest kwasem karboksylowym i dość słabym kwasem w porównaniu z kwasami nieorganicznymi, takimi jak kwas solny. W roztworze wodnym duża część cząsteczek jest niezdysocjowana jako H3 C-COOH wcześniej. Tutaj również szybko ustala się równowaga. Z tego powodu powyższe równanie reakcji (2) można czytać od prawej do lewej z równym uzasadnieniem. Anion octanowy reaguje z jonem oksoniowym, tworząc wodę i kwas octowy. W tym kierunku czytania zachodzi podstawowa reakcja zamiast tego:Konwersja jonów hydroksoniowych w cząsteczki wody. Jeżeli do roztworu kwasu octowego dodaje się odpowiednią ilość anionów octanowych, na przykład w postaci łatwo rozpuszczalnego octanu sodu, to właściwość kwasową kwasu octowego można całkowicie skompensować właściwością zasadową jonu octanowego. Wodny roztwór jest neutralizowany. Neutralny nie oznacza, że w rozwiązaniu nic się nie dzieje. Tylko stężenie H3 Jony O są tak niskie, jak w czystej wodzie.
Ponadto reakcja podstawowa należy wziąć pod uwagę, co ma miejsce, gdy octan sodu jest czysty woda jest rozpuszczona:
Tworzą się tutaj jony wodorotlenkowe (OH). Dodanie odpowiedniej ilości wodnego roztworu kwasu octowego do tego roztworu octanowego powoduje, że roztwór jest neutralny . Stoi między H3 O i OH wchodzą w stan równowagi (1) początkowo przedstawiony jako fundamentalna właściwość wody i reprezentowany jako odwrócone równanie (1a).
| Kwas można rozumieć jako związek chemiczny, który ma zdolność w roztworze wodnym H3 tworzyć jony O lub przekształcać jony OH w cząsteczki wody. Z kolei zasada ma zdolność tworzenia jonów OH lub H3 w roztworze wodnym O do H2 O. |
Wiele substancji określanych jako kwasy to roztwory wodne od samego początku i nie można ich łatwo zrozumieć jako związki chemiczne, które mają jonowo związane atomy wodoru. Kwas solny to roztwór wodny chlorowodoru gazu (HCl) i jest uważany za mocny kwas. W tym rozwiązaniu - przed jakimkolwiek praktycznym użyciem kwasu - istnieje już równowaga (4), w której równowaga jest prawie całkowicie po prawej stronie.
Chlorowodór już dawno wyczerpał swój potencjał bycia kwasem i H3 Powstały jony O. Efekty chemiczne wynikające z praktycznego stosowania kwasu solnego są spowodowane reakcjami H3 przypisane jonom O. Kwasem jest H3 Jon O. Miarą kwasowości (stężenia) jest tutaj wartość pH, natomiast w przypadku słabszych kwasów, takich jak kwas octowy, na pierwszym planie jest miara siły kwasu, czyli wartość pKa. Silne i słabe kwasy różnią się tendencją „lubię” lub „mniej lubię” H3 do tworzenia jonów O w wodzie. Rozdział Bilans kwasowo-zasadowy opisuje te tendencje bardziej szczegółowo.
| Efekt chemiczny w praktycznym użyciu kwasu dotyczy głównie H3 Jony O z powrotem. Za najważniejszy kwas można uznać jony oksoniowe. |
Równowaga kwasowo-zasadowa
Podczas protolizy reagent (zwykle woda) pochłania proton wydzielany przez kwas. Należy to odróżnić od reakcji redoks, w których zachodzą transfery elektronów.
Ogólna równowaga reakcji kwasu HA w roztworze wodnym jest:
Kwasy różnią się tendencją do przenoszenia jonów H do wody. Nazywa się to Siła kwasu K s oznacza i wskazuje stałą równowagi (stałą kwasową) reakcji kwasowej. Stała kwasowości jest często podawana w postaci pK s -wartość, która jest zdefiniowana jako ujemny logarytm stałej kwasowości.
Kwasy przez duże K s -wartość (małe pK s -wartość) to mocne kwasy. Jeśli pH roztworu zawierającego kwas jest o dwie jednostki poniżej pK s wartość, tylko jedna setna H3 Powstały jony O.
Kwasy wielozasadowe
Kwasy, które mogą oddzielić kilka protonów, nazywane są kwasami poliprotonowymi . Kwas siarkowy (H2 SO4 ) jest diprotycznym (również diprotycznym) kwasem fosforowym (H3 PO4 ) kwas trójprotonowy (również trójprotonowy). Próba uwolnienia poszczególnych protonów (protoliza) ma różną wielkość i można ją obliczyć za pomocą stałej kwasowej (Ks ) opisać. Ogólnie rzecz biorąc, dla poszczególnych etapów protolizy obowiązuje:Ks (I)> Ks (II)> Ks (III) (lub pKs (I)
Dla kwasu fosforowego:
pKS -Wartości ważnych kwasów
Reakcje kwasowo-zasadowe bez wody
Analogicznie do reakcji kwasowo-zasadowych zachodzących w roztworach wodnych iz udziałem wody, zachodzą reakcje w innych ośrodkach. W bezwodnym etanolu zachodzi reakcja z chlorowodorem, w którym etanol pełni rolę zasady:
W fazie gazowej gazy amoniak i chlorowodór reagują, tworząc sól chlorek amonu.
Oprócz wody inne wystarczająco polarne rozpuszczalniki mogą również działać jako reagenty w reakcjach kwasowo-zasadowych. Dobrym przykładem jest autoprotoliza ciekłego amoniaku:
Przykłady kwasów
Ważnymi kwasami są:
- Kwas siarkowy:H2 SO4 (zastosowanie przemysłowe, kwaśne deszcze)
- Kwas solny:HCl (zastosowanie przemysłowe)
- Kwas fosforowy:H3 PO4 (Przemysł spożywczy, w tym cola, materiał genetyczny)
- Kwas węglowy:H2 CO3 (przemysł spożywczy, technologia, atmosfera)
- Kwas octowy:CH3 COOH (przemysł spożywczy)
- Kwas fluorowodorowy:HF (produkcja chipów komputerowych)
- Kwas azotowy:HNO3 (zastosowanie przemysłowe)
Sole kwasów wielozasadowych mogą również działać jako kwasy („sole kwaśne”), na przykład
- Wodorosiarczany
- Wodorofosforany
Referencje
Historyczny rozwój kwasów:
- Claus Priesner, Karin Figala:Alchemia:encyklopedia nauki hermetycznej. Beck, Monachium 1998, ISBN 3406441068
- V. Karpenko, J.A. Norris:Witriol w historii chemii. Chem. Listy, t. 96, 2002, s. 997-1005 [2]
- Darczyńcy w Britannicy
- Lista kwasów
- podstawy
- Koncepcje kwasowo-zasadowe