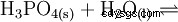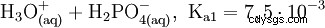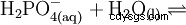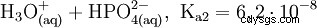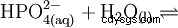| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Ogólne | |||||||
| Nazwa | kwas fosforowy | ||||||
| Inne nazwy | kwas ortofosforowy | ||||||
| Formuła molekularna | H3 PO4 | ||||||
| Numer CAS | 7664-38-2 | ||||||
| Krótki opis | bezbarwne i bezwonne ciało stałe | ||||||
| Właściwości | |||||||
| Masa molowa | 98,00 g mol | ||||||
| Stan materii | ciało stałe (często płynne, ponieważ przechłodzony stop może być przechowywany przez długi czas) | ||||||
| Gęstość | 1.834 g cm (18°C) | ||||||
| Temperatura topnienia | 42,35 °C | ||||||
| Temperatura wrzenia | Rozkład:213 °C (odwodnienie) | ||||||
| Ciśnienie pary | 3,8 Pa (20 °C) | ||||||
| wartość pKa | 2.16; 7.21; 12.32 | ||||||
| Rozpuszczalność | w pełni mieszalny z wodą, łatwo rozpuszczalny w alkoholu | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| MAK | 2 mg m (respirabilna frakcja aerozolowa) | ||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
normalny lub orto- Kwas fosforowy jest głównym kwasem fosforu. Substancja bezwodna jest wysoce higroskopijna. Jest to kwas trójprotonowy i reaguje jako umiarkowanie mocny kwas w odniesieniu do pierwszej deprotonacji. Z niego pochodzą kondensaty kwasu difosforowego, kwasu meta- i polifosforowego. Jako dodatek do żywności kwas fosforowy jest wymieniony jako E 338 zadeklarowane.
Uzyskiwanie i wyświetlanie
Kwas fosforowy można otrzymać z fosforytu (głównie apatytu, Ca5 (PO4 )3 (F, OH, Cl)) z kwasem siarkowym, kwasem chlorowodorowym lub kwasem azotowym. CaSO4 powstają jako produkty uboczne (anhydryt, gips) i H2 [SiF6 ] (kwas heksafluorokrzemowy). Alternatywnie, kwas fosforowy można otrzymać przez spalanie fosforu elementarnego z wytworzeniem pięciotlenku fosforu, P4 O10 , a następnie hydroliza (tzw. termiczny kwas fosforowy).
Właściwości
Kwas fosforowy jest kwasem trójzasadowym, który może oddać swój wodór jako solwatowane protony w trzech etapach, tworząc aniony diwodorofosforanowe, wodorofosforanowe i fosforanowe. Powiązane wartości pKs to pKs1 =2,161; pKs2 =7,207 i pKs3 =12,325.
Wykorzystanie
Kwas fosforowy jest wykorzystywany jako surowiec do produkcji nawozów zawierających fosforany (>90% produkcji w USA), detergentów, odrdzewiaczy lub konwertorów oraz do pasywacji żelaza i cynku w celu ochrony przed korozją. Cement cynkowo-fosforanowy jest stosowany w stomatologii.
Choć w wysokich stężeniach działa żrąco, w przemyśle spożywczym stosowany jest w postaci rozcieńczonej jako konserwant, zakwaszacz (zwłaszcza w napojach cola) oraz jako regulator kwasowości (E 338), ponieważ kwas fosforowy jest nietoksyczny dla organizmu człowieka , oprócz efektu żrącego. Nadaje się również do przygotowywania roztworów buforowych (różne „bufory fosforanowe”).
Znaczenie biologiczne
Estry kwasu fosforowego odgrywają kluczową rolę w metabolizmie, zwłaszcza jako nośniki energii i grup (patrz np. ATP i GTP). Są integralną częścią DNA, RNA, wielu koenzymów itp.
Dowód
Kwas fosforowy i rozpuszczalne fosforany można oddzielić przez wytrącenie molibdenianem amonu z wytworzeniem żółtego fosforanu molibdenianu amonu lub przez wytrącenie jonami magnezu w roztworze amoniaku z wytworzeniem MgNH4 PO4 udowodnić.
Źródła
- ↑ RÖMPP Online, Thieme 2007
- ↑ Baza danych substancji BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 3 marca 2007
- ↑ ESIS – Europejski System Informacji o Substancjach Chemicznych
- inne związki tlenowe fosforu