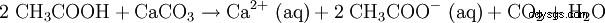| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Ogólne | |||||||
| Nazwa | Kwas octowy | ||||||
| Inne nazwy |
| ||||||
| Formuła molekularna | C2 H4 O2 | ||||||
| Numer CAS | 64-19-7 | ||||||
| Krótki opis | bezbarwna ciecz o ostrym zapachu | ||||||
| Właściwości | |||||||
| Masa molowa | 60,05 g mol | ||||||
| Stan materii | ciecz | ||||||
| Gęstość | 1,05g cm | ||||||
| Temperatura topnienia | 17 °C | ||||||
| Temperatura wrzenia | 118°C | ||||||
| Ciśnienie pary | 16hPa (20°C) | ||||||
| wartość pKa | 4,75 | ||||||
| Rozpuszczalność | całkowicie mieszalny z wodą (20 °C) | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| MAK | nie określono | ||||||
| Właściwości termodynamiczne | |||||||
| ΔHf | −483,52 kJ mol | ||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
Kwas octowy , zgodnie z rozporządzeniem IUPAC kwas etanowy , to bezbarwny, płynny, kaustyczny kwas karboksylowy o typowym zapachu octu. Jako dodatek do żywności posiada oznaczenie E260. Wodne roztwory kwasu octowego są trywialnie nazywane tylko octem i stężonym kwasem octowym lodowatym kwasem octowym. Łacińska nazwa kwasu octowego to Acidum aceticum . Sole kwasu octowego nazywane są octanami wyznaczony. W biochemii termin octan jest korzystniejszy niż termin kwas octowy, ponieważ kwas octowy w dużej mierze deprotonuje w warunkach fizjologicznych jako anion octanowy (CH3 Dyrektor Operacyjny) jest obecny.
Uzyskiwanie i wyświetlanie
Klasyczna produkcja ekologiczna
Klasyczną produkcją kwasu octowego jest fermentacja. Bakterie Acetobacter przekształcają etanol (alkohol) wytwarzany w innych procesach fermentacyjnych w kwas octowy (ocet fermentacyjny). Produkty wyjściowe mogą m.in. np. wino, piwo lub słód.Ocet domowy składa się z octu fermentacyjnego lub rozcieńczonego octu syntetycznego i zawiera 5% kwasu octowego. Esencja octu jest 25% syntetycznym roztworem kwasu octowego w wodzie, ma silny, ostry zapach i może być stosowany tylko w rozcieńczeniu w żywności.
Produkcja chemiczna na dużą skalę
Najważniejszą przemysłową syntezą kwasu octowego jest katalityczna konwersja metanolu za pomocą tlenku węgla pod ciśnieniem (proces Monsanto).
CH3OH + CO → CH3COOH
Oprócz tego kwas octowy można również zsyntetyzować poprzez utlenianie aldehydu octowego powietrzem lub tlenem przy użyciu Mn(OAc)2 jako katalizator lub przez częściowe utlenianie innych węglowodorów.
Technicznie rzecz biorąc, stosuje się również utlenianie powietrzem n-butanu w temperaturze około 180 °C i 85 bar oraz katalityczne utlenianie benzyny lekkiej.
Właściwości
Właściwości fizyczne
Gdy kwas octowy rozpuszcza się w wodzie, około co setna cząsteczka kwasu octowego dysocjuje, tworząc jon octanowy. Odszczepiony proton jest przenoszony do cząsteczki wody. Powstające w tym procesie jony oksoniowe powodują kwasowe właściwości roztworów kwasu octowego.
W temperaturze 118 °C kwas octowy ma stosunkowo wysoką temperaturę wrzenia w porównaniu z substancjami polarnymi o porównywalnej masie molowej (np. 1-propanol:temperatura wrzenia 97 °C). Powodem tego jest zdolność cząsteczek kwasu octowego do tworzenia dwóch „wzajemnych” wiązań wodorowych poprzez ich grupy karboksylowe, tak że dimery powstają z dwóch cząsteczek kwasu octowego, które zachowują się jak cząsteczka o dwukrotnie większej masie molowej. Dlatego też do przeniesienia tych dimerów do fazy gazowej potrzebna jest większa ilość energii, co można rozpoznać po „podwyższonej” temperaturze wrzenia.
Właściwości chemiczne
Kwas octowy całkowicie utlenia się w powietrzu, tworząc wodę i dwutlenek węgla.
Metale nieszlachetne, takie jak magnez, wapń, cynk lub żelazo rozpuszczają się w rozcieńczonym kwasie octowym, tworząc rozpuszczalne w wodzie octany i uwalniając wodór.
Kwas octowy reaguje z miedzią w obecności tlenu (powietrza), tworząc octan miedzi, zieloną, szkodliwą sól, lepiej znaną jako patyna.
Kwas octowy reaguje z etanolem, tworząc octan etylu, powszechnie stosowany rozpuszczalnik. Zastąpienie 1-pentanolu etanolem daje octan amylu, który jest silnie pachnącym estrem. Kwas salicylowy można również estryfikować kwasem octowym. W ten sposób powstaje kwas acetylosalicylowy, aktywny składnik aspiryny.
Kwas octowy reaguje w temperaturze 800 °C z odwodnieniem do bezwodnika octowego.
Rozcieńczony kwas octowy jest również używany do rozpuszczania kamienia (patrz ocet). Równanie reakcji wygląda tak:
Właściwości termodynamiczne
Standardowa entropia cieczy przy 1 bar (Sl, 1 bar ) wynosi 158,0 J mol K, czyli ciała stałego (Ss ) 282,84 J mol K.
Wykorzystanie
Kwas octowy ma ogromne znaczenie jako środek aromatyzujący. Kwas octowy i jego sole octan potasu (E 261), octan sodu (E 262) i octan wapnia (E 263) są stosowane jako środki zakwaszające do owoców i warzyw w puszkach i słoikach (0,5–3% kwas octowy), do wszelkiego rodzaju ryby, przetwory, różne marynaty, sałatki garmażeryjne, majonez, sosy sałatkowe wraz z kwasem sorbinowym (E 200) lub kwasem benzoesowym (E 210) oraz do marynowania i mycia świeżego mięsa.
Działanie bakteriobójcze kwasu octowego polega na tym, że zmieniona wartość pH zapobiega procesom fizjologicznym, a także denaturuje białka.
Kwas octowy jest również używany w produkcji kosmetyków (kremy, mydła).
Sole kwasu octowego (octany)
Sole lub estry kwasu octowego nazywane są octanami wyznaczony. Są to głównie bezbarwne sole krystaliczne zawierające anion octanowy (CH3 Dyrektor operacyjny).
Przykładami octanów podobnych do soli są octan sodu (NaCH3 COO), octan potasu (KCH3 COO) lub octan ołowiu(II) (Pb(CH3 .) Dyrektor operacyjny)2 ).
Octany podobne do soli otrzymuje się przez neutralizację kwasu octowego wodorotlenkami metali lub tlenkami metali:
-
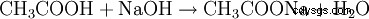
- Kwas octowy i wodorotlenek sodu reagują, tworząc octan sodu i wodę.
-
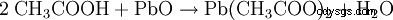
- Kwas octowy i tlenek ołowiu(II) wytwarzają octan ołowiu i wodę.
W analizie chemicznej octany można łatwo wykryć przez zmielenie próbki z wodorosiarczanem potasu w moździerzu. W tym procesie proton (H) jonu wodorosiarczanowego jest przenoszony na jon octanowy, w wyniku czego powstaje lotny kwas octowy, który można łatwo zidentyfikować po charakterystycznym zapachu:
-

- Octan jest protonowany przez wodorosiarczan. Powstają kwas octowy i siarczan.
Estry kwasu octowego zawierają rodnik acetylowy jako rodnik kwasowy. Najbardziej znanym z tych estrów jest octan etylu. Octany organiczne otrzymuje się przez estryfikację kwasu octowego alkoholami (R-OH):
-

- Kwas octowy i alkohol reagują, tworząc ester kwasu octowego i wodę.
Źródła
- ↑ Baza danych substancji BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 sierpnia 2007