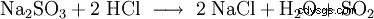| wzór strukturalny | |||||||
|---|---|---|---|---|---|---|---|
| Ogólne | |||||||
| Nazwa | Dwutlenek siarki | ||||||
| Inne nazwy | Tlenek siarki(IV), bezwodnik siarkawy | ||||||
| Formuła molekularna | SO2 | ||||||
| Numer CAS | 7446-09-5 | ||||||
| Krótki opis | bezbarwny, gryzący, toksyczny gaz | ||||||
| Właściwości | |||||||
| Masa molowa | 64,06 g mol | ||||||
| Stan materii | gazowy | ||||||
| Gęstość | 2,73 kg·m (1 bar, 15°C) | ||||||
| Temperatura topnienia | -75 °C | ||||||
| Temperatura wrzenia | -10 °C | ||||||
| Ciśnienie pary | 3,3 bara (21°C) | ||||||
| Rozpuszczalność | dobra (112 g/l ) w wodzie | ||||||
| Instrukcje bezpieczeństwa | |||||||
| |||||||
| MAK | 1,3 mg m | ||||||
| Tam, gdzie jest to możliwe i powszechne, używane są jednostki SI. O ile nie zaznaczono inaczej, podane dane dotyczą standardowych warunków. | |||||||
Dwutlenek siarki , SO2 , jest bezwodnikiem kwasu siarkawego H2 SO3 . Dwutlenek siarki jest bezbarwnym, toksycznym gazem o ostrym zapachu i kwaśnym smaku. Powstaje głównie podczas spalania paliw kopalnych zawierających siarkę, takich jak węgiel lub produkty ropopochodne, które zawierają do 4% siarki. W efekcie znacząco przyczynia się do zanieczyszczenia powietrza, jest przyczyną kwaśnych deszczy, gdzie dwutlenek siarki jest najpierw utleniany tlenem do trójtlenku siarki, a następnie z wodą do kwasu siarkowego (H2 SO4 ). Aby temu zapobiec, istnieją różne procesy odsiarczania spalin.
Produkcja
- przez spalanie siarki lub siarkowodoru
- przez prażenie rud siarczkowych
np. B. pirytu:
-

- Dwusiarczek żelaza(II) i tlen reagują, tworząc tlenek żelaza(III) i dwutlenek siarki.
- z siarczynów mocniejszymi kwasami
Właściwości
| Numer E | 220 |
| temperatura krytyczna | 157,5°C |
| ciśnienie krytyczne | 7,9 bara |
Mezomeryczny wzór limitu dwutlenku siarki jest następujący:
Ogólnie:
Płynny dwutlenek siarki rozpuszcza wiele substancji i dlatego stał się cennym rozpuszczalnikiem.
Wykorzystanie
Dwutlenek siarki występuje w przemyśle spożywczym pod nazwą E 220 stosowany jako konserwant i przeciwutleniacz, szczególnie do suszonych owoców, dań z ziemniaków, soków owocowych, dżemów i wina, a także do produkcji chlorku sulfurylu SO2 Cl2 i chlorek tionylu SOCl2 .
Ponadto dwutlenek siarki jest ważnym surowcem wyjściowym do produkcji trójtlenku siarki, aby następnie wytworzyć stężony kwas siarkowy, np. kwas siarkowy. B. metodą kontaktową.
Dwutlenek siarki jest również używany do produkcji wielu chemikaliów, leków i barwników oraz do bielenia papieru i tekstyliów.
Zanieczyszczenie
W wysokich stężeniach SO2 uszkadza ludzi, zwierzęta i rośliny. Produkty utleniania powodują „kwaśne deszcze”, które zagrażają wrażliwym ekosystemom, takim jak lasy i jeziora oraz atakują budynki i materiały.
Całkowite emisje SO2 zostały znacznie zmniejszone w rozwiniętych krajach uprzemysłowionych w ciągu ostatnich dwóch dekad dzięki zastosowaniu niskosiarkowych lub bezsiarkowych paliw i paliw.
Instrukcje bezpieczeństwa
Stężenie dwutlenku siarki powyżej wartości MAK może powodować u ludzi bóle głowy, nudności i senność. W wyższych stężeniach gaz poważnie uszkadza oskrzela i płuca, a nawet kwasy nukleinowe, nośniki właściwości dziedzicznych.
Źródła
- ↑ Karta charakterystyki substancji niebezpiecznej (Praxair)
- ↑ Baza danych substancji niebezpiecznych BGIA Gestis
- ↑ Holleman-Wiberg:Podręcznik chemii nieorganicznej Wydanie 102, de Gruyter, Berlin, 2007.