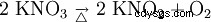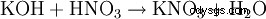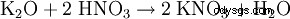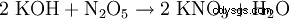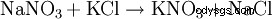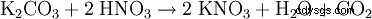| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| K | |||||||
| Generale | |||||||
| Nome | nitrato di potassio | ||||||
| Altri nomi |
| ||||||
| Formula molecolare | KNO3 | ||||||
| Numero CAS | 7757-79-1 | ||||||
| Breve descrizione | polvere cristallina bianca | ||||||
| Proprietà | |||||||
| Massa molare | 101,11 g mol | ||||||
| Stato della materia | risolto | ||||||
| Densità | 2.109 g cm (16 °C) | ||||||
| Punto di fusione | 334 °C | ||||||
| Punto di ebollizione | Decomposizione>400 °C | ||||||
| Solubilità | buono in acqua (316 g/L a 20 °C), povero di solventi apolari | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
nitrato di potassio , meglio conosciuto come salnitro nel linguaggio comune , in particolare come nitrato di potassio , è il sale di potassio dell'acido nitrico.
Proprietà
Il nitrato di potassio forma cristalli incolori, che si dissolvono in acqua con un forte raffreddamento. È quindi molto più facilmente solubile in acqua calda che in acqua fredda. Si possono sciogliere fino a 130 g di nitrato di potassio in 1 litro di acqua a 0°C e fino a 2455 g di nitrato di potassio in 1 litro di acqua a 100°C. A concentrazioni così elevate, la densità della soluzione è significativamente maggiore di quella dell'acqua pura.
Il nitrato di potassio si decompone in nitrito di potassio e ossigeno per riscaldamento:
È un ottimo ossidante a temperature elevate. Il residuo carbonizzato nella vetreria si dissolve rapidamente nel nitrato di potassio fuso.
Il nitrato di potassio è significativamente meno igroscopico di molti altri nitrati, ad es. B. Nitrato di sodio.
Estrazione
- Casi naturali
Il nitrato di potassio (min. "Nitrokalit") si presenta come efflorescenze sui terreni. Di importanza economica erano i giacimenti in Cina e nel sud-est asiatico, dove nella prima metà del 19° secolo venivano estratte più di 10.000 tonnellate di salnitro ogni anno per lisciviazione di tali suoli.
- Nitrificazione batterica dei rifiuti organici ricchi di azoto Dalla fine del 14° al 19° secolo, il salnitro è stato prodotto in Europa con l'aiuto dei batteri e dell'ossigeno atmosferico per essere indipendente dall'importazione di questa materia prima, indispensabile per scopi bellici. (vedi "Cronologia"). I rifiuti organici ricchi di azoto (sterco e urina) vengono mescolati con calce e cenere di legno (potassa) e lasciati a decomporsi in cumuli di terra sciolti e permeabili all'aria. I composti azotati vengono convertiti in nitrati dai batteri. Dopo due anni, la massa viene lisciviata con acqua. La potassa viene aggiunta alla liscivia grezza, convertendo così il nitrato di calcio e magnesio in nitrato di potassio e il carbonato alcalino terroso scarsamente solubile. Il nitrato di potassio si ottiene evaporando la liscivia filtrata, che viene poi purificata mediante ricristallizzazione.
- Conversione salnitro
Dalla metà del XIX secolo fino al 1920 circa, la conversione del nitrato cileno con cloruro di potassio è stato il processo più importante per la produzione di nitrato di potassio:NaNO3 + KCl --> KNO3 + NaCl
Qui viene utilizzato il leggero aumento della solubilità del cloruro di sodio con la temperatura:l'acqua madre di KNO3 -La cristallizzazione nel ciclo precedente viene riscaldata e addizionata di nitrato di sodio grezzo e cloruro di potassio in rapporto stechiometrico. La miscela viene concentrata con l'aggiunta di un po' di soda a 100°C, durante la quale precipitano e si filtrano cloruro di sodio e impurità (carbonati di metalli alcalino terrosi). Il filtrato viene nuovamente diluito con il condensato dell'evaporazione per evitare la precipitazione dei sali di sodio durante il raffreddamento, filtrato limpido e quindi raffreddato a 5°C per cristallizzare il nitrato di potassio e centrifugato. Il nitrato di potassio separato viene ricristallizzato per scopi tecnici.
- Sintetico da acido nitrico
Oggi il nitrato di potassio viene prodotto sinteticamente (vedi Rappresentazione ).
Aspetto (creazione)
Esistono molti modi per rappresentare il nitrato di potassio:
- da quasi tutte le reazioni di formazione di sale :
- da carbonato di potassio:
Utilizzo
- Il nitrato di potassio viene utilizzato per la conservazione degli alimenti (sale per salatura E 252)
- Utilizzato per produrre polvere nera e altre miscele pirotecniche
- Una miscela di 24% boro + 71% KNO3 + 5% di legante (PMMA) funge da miscela di accensione affidabile che brucia anche a temperature molto basse (-196°C).
- Una miscela al 60% di NaNO3 +40% KNO3 fonde a 222°C ed è utilizzato come mezzo di scambio termico negli impianti solari termici. Questo sale fuso è chimicamente stabile fino a 590 °C, ha un'elevata capacità termica specifica di 1,55 kJ/(kg K), una densità di 1,79 g/cm³ ed è sottile come l'acqua (viscosità:2,1 mPa·s). Bagna molto facilmente le superfici metalliche, il che può portare a problemi di sigillatura se la costruzione e la scelta del materiale non sono adatte. Gli acciai inossidabili sono ampiamente resistenti ai nitrati fusi (tasso di erosione:6 - 15 µm/anno a 570 °C). Il coefficiente di scambio termico al tubo di flusso turbolento è di circa 6000 W/K m². Grazie alla sua elevata capacità termica (2,8 MJ/(K m³)), il salnitro fuso è adatto anche come mezzo di accumulo di calore. La temperatura di fusione può essere ulteriormente ridotta aggiungendo nitrito di sodio. Una miscela di sale al 53% KNO3 chiamata HiTec + 40% NaNO2 + 7% NaNO3 fonde a 140°C e ha proprietà particolarmente favorevoli come mezzo di scambio termico se la tossicità del nitrito di sodio è irrilevante.
- I bagni di salnitro sono utilizzati per il trattamento termico di leghe di alluminio lavorato con un contenuto di magnesio fino al 10%. La temperatura massima ammissibile del sale fuso dipende dal contenuto di magnesio; si passa da 550°C allo 0,5% Mg a 380°C al 10% Mg.
- in granate fumogene
- nel fertilizzante
Cronologia
Già nell'XI secolo il salnitro è menzionato nel libro di Marcus Graecus, che menziona per la prima volta anche la miscela di polvere nera, come una nuova sostanza che viene raschiata da terra e pietre. Il libro della fine del XIII secolo sul combattimento a cavallo e l'uso delle macchine da guerra di Hassan ar-Rammah (Al-Furusiyya wa al-Manasib al-Harbiyya ) contiene già diversi regolamenti per pulire il salnitro con cenere di legno e per preparare ordigni incendiari e carburante per razzi.
Il salnitro fu inizialmente importato dall'India; Venezia traeva alti profitti dal commercio intermedio. Con la crescente domanda e per ragioni di indipendenza, dalla fine del XIV secolo i governi promossero la propria produzione di salnitro e si assicurarono tutti i diritti di produzione, importazione e uso per mezzo di leggi draconiane attraverso un "regime del salnitro". A causa del rapido rilascio di ossigeno, il salnitro è stato la base per l'improvvisa combustione di zolfo e carbone in polvere da sparo e quindi, in quanto sostanza cronicamente scarsa, la materia prima strategica per sei secoli.
In Turingia c'erano nove opere di salnitro nel XVI secolo. Le rive della Moldava vicino a Praga furono ricoperte di "banchi sanitari" e la città di Halle concesse una concessione per estrarre il salnitro dalle discariche. La crescente domanda di salnitro è stata in parte soddisfatta da ulteriori importazioni, principalmente dall'India, e da impianti propri.
Dalla fine del XIV secolo i giardini del salnitro furono sistematicamente coltivati. I rifiuti animali (sterco, feci, urina e sangue) erano riempiti con terra calcarea, terra di cimiteri o macelli o di paludi e con calce, detriti e cenere in fosse o accatastati e occasionalmente versati con letame liquido o urina. Dopo un anno o due, la decomposizione produsse così tanto salnitro che poteva essere lavato via dalla terra. La resa era di circa 6:1, ovvero da 6 kg di terra nitrata si otteneva 1 kg di salnitro.
Le caldaie a salnitro come professione speciale e molto impopolare potevano entrare in qualsiasi momento nelle proprietà e cercarvi il salnitro. Ciò valeva anche per le chiese dei secoli XVII e XVIII, esclusi i tempi di culto. In Svezia, gli agricoltori hanno persino dovuto pagare parte delle tasse in salnitro.
Nel diciannovesimo secolo ci fu persino una guerra dei nitrati, che il Cile condusse contro i paesi vicini per ottenere il possesso esclusivo degli enormi giacimenti desertici di nitrato di sodio ("Caliche"), che ora potevano essere immediatamente convertiti con sali di potassio per formare nitrato di potassio. Questo processo di conversione fu finalmente sostituito dal 1916 dal processo Haber-Bosch di generazione di ammoniaca dall'aria e dall'acqua con successiva conversione in acido nitrico.
Fonti
- ↑ Voce su nitrato di potassio nel database delle sostanze GESTIS della BGIA, recuperato il 3 settembre 2007 (JavaScript richiesto)
Riferimenti
- Perry, RH, Chemical Engineers' Handbook, 4a ed., McGraw-Hill Book Company, New York, 1963, pp. 9-77
- Janz, GH, et al., Compilazioni di dati sulle proprietà fisiche rilevanti per l'accumulo di energia II Sali fusi, NSRDS, aprile 1979
- Gartz,J, Storia culturale degli esplosivi, E.S.Mittler &Son, Amburgo, 2006