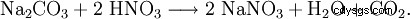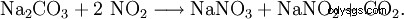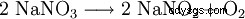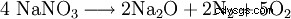| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Bene | |||||||
| Generale | |||||||
| Nome | Nitrato di sodio | ||||||
| Altri nomi |
| ||||||
| Formula molecolare | NaNO3 | ||||||
| Numero CAS | 7631-99-4 | ||||||
| Breve descrizione | solido cristallino incolore | ||||||
| Proprietà | |||||||
| Massa molare | 84,99 g mol | ||||||
| Stato della materia | risolto | ||||||
| Densità | 2,26 g cm | ||||||
| Punto di fusione | 306,8 °C | ||||||
| Punto di ebollizione | Decomposizione da 380 °C | ||||||
| Pressione di vapore | <0,001 hPa (25°C) | ||||||
| Solubilità | facilmente solubile in acqua:874 g/l (a 20 °C) | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| MAC | non specificato | ||||||
| LD50 | 1267 mg kg (ratto, orale) | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Nitrato di sodio (anche nitrato di natrone o salnitro cileno ) è un composto chimico, il sale sodico dell'acido nitrico. Allo stato puro, si presenta sotto forma di una sostanza bianca igroscopica (che attira l'acqua) o di cristalli incolori.
Occorrenze
Il nitrato di sodio è il nitrato naturale più importante. La località principale è il Cile, da cui il nome comune Salnitro del Cile. Ci sono altri giacimenti naturali in Egitto, Asia Minore, Colombia e California.
Estrazione
I depositi naturali vengono ripuliti dai corpi estranei mediante filtrazione di salamoie calde ottenute per lisciviazione con acqua calda. Il nitrato di sodio che cristallizza al freddo ha una purezza di circa il 98%. Lo iodato contenuto nelle acque madri viene utilizzato per l'estrazione dello iodio.
Il nitrato di sodio può essere ottenuto anche facendo reagire il carbonato di sodio con l'acido nitrico:
L'assorbimento dei gas residui dall'ossidazione dell'ammoniaca in una soluzione concentrata di carbonato di sodio è l'ideale qui:
Per ossidare il nitrito, viene acidificato con acido nitrico, ossidato a nitrato in aria e neutralizzato con carbonato di sodio. È concentrato in un solido in evaporatori sottovuoto.
Proprietà
Proprietà fisiche
- Importanti proprietà termodinamiche
- Δf Hs :15,5 in kJ/mol
- Ss :116 in J/(mol K)
Proprietà chimiche
In acido solforico caldo, viene convertito in idrogeno solforato di sodio con formazione di acido nitrico:
A temperature superiori a 380 °C si decompone in nitrito di sodio:
A temperature superiori a 800 °C all'ossido di sodio:
Utilizzo
- Fertilizzante
- Industria dei materiali da costruzione:additivo cementizio
- Produzione chimica:nitrato di potassio
- Precedentemente utilizzato anche per produrre acido nitrico
- come conservante E 251
- per la stagionatura di carni e salumi (anche con nitrito di sodio E 250 e nitrito di potassio E 249)
- PCM per accumulo termico
Additivo alimentare
Il nitrato agisce contro i batteri, in particolare contro il temuto patogeno del botulismo (Clostridium botulinum). Durante il processo di polimerizzazione, il pigmento muscolare chimicamente meno stabile (mioglobina) viene convertito in una variante più stabile (arrossamento). Di conseguenza, la carne mantiene il suo colore rosso. Le carni crude e le salsicce assumono un colore grigio che viene scambiato per la maggior parte dei consumatori come un'indicazione di deterioramento. Inoltre, durante la stagionatura si forma un tipico aroma.
Il nitrato di sodio viene utilizzato per salsicce, formaggi a pasta dura, semidura, aringhe in salamoia e spratti.
I nitrati stessi sono innocui. Il loro utilizzo è problematico perché vengono convertiti in nitriti. Questa conversione è possibile negli alimenti, ma anche nel corpo umano I nitriti hanno un effetto vasodilatatore e ipotensivo. A dosi più elevate, possono portare a sintomi acuti di avvelenamento. (Mancanza del pigmento sanguigno emoglobina =dipendenza dal blu). I nitriti possono essere convertiti in nitrosammine altamente cancerogene nel corpo umano con l'assorbimento simultaneo di proteine.
Prova
- Reazioni di rilevamento
- Sodio:come il giallo brillante della fiamma blu del becco Bunsen
- Nitrato:sciogliere la punta della spatola della sostanza in acido solforico diluito e aggiungere una soluzione fredda e satura di solfato di ferro(II). Sottostrato con poco acido solforico concentrato. In corrispondenza dello strato limite si forma un anello marrone, che è a prova di nitrato (test dell'anello).
Fonti
- ↑ Database delle sostanze BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 15 giugno 2007