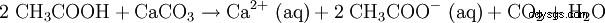| formula strutturale | |||||||
|---|---|---|---|---|---|---|---|
| Generale | |||||||
| Nome | Acido acetico | ||||||
| Altri nomi |
| ||||||
| Formula molecolare | C2 H4 O2 | ||||||
| Numero CAS | 64-19-7 | ||||||
| Breve descrizione | liquido incolore dall'odore pungente | ||||||
| Proprietà | |||||||
| Massa molare | 60,05 g mol | ||||||
| Stato della materia | liquido | ||||||
| Densità | 1,05 g cm | ||||||
| Punto di fusione | 17°C | ||||||
| Punto di ebollizione | 118°C | ||||||
| Pressione di vapore | 16 hPa (20°C) | ||||||
| valore pKa | 4.75 | ||||||
| Solubilità | completamente miscibile con acqua (20 °C) | ||||||
| Istruzioni di sicurezza | |||||||
| |||||||
| MAC | non impostato | ||||||
| Proprietà termodinamiche | |||||||
| ΔHf | −483,52 kJ mol | ||||||
| Ove possibile e comune, vengono utilizzate le unità SI. Salvo diversa indicazione, i dati forniti si applicano a condizioni standard. | |||||||
Acido acetico , secondo il regolamento IUPAC acido etanoico , è un acido carbossilico incolore, liquido, caustico, con un tipico odore di aceto. Come additivo alimentare, ha la denominazione E260. Le soluzioni acquose di acido acetico sono banalmente chiamate solo aceto e acido acetico concentrato acido acetico glaciale. Il nome latino dell'acido acetico è Acidum aceticum . I sali dell'acido acetico sono chiamati acetati designato. In biochimica, il termine acetato è preferito a quello di acido acetico, poiché l'acido acetico deprotona ampiamente in condizioni fisiologiche come l'anione acetato (CH3 COO) è presente.
Ottenere e visualizzare
Produzione biologica classica
La classica produzione di acido acetico è la fermentazione. I batteri Acetobacter convertono l'etanolo (alcol) prodotto da altri processi di fermentazione in acido acetico (aceto di fermentazione). I prodotti di partenza possono ad es. g. vino, birra o malto.Aceto domestico è costituito da aceto di fermentazione o aceto sintetico diluito e contiene il 5% di acido acetico. Essenza di aceto è una soluzione di acido acetico sintetico al 25% in acqua, ha un forte odore pungente e può essere utilizzato solo diluito negli alimenti.
Produzione chimica su larga scala
La sintesi industriale più importante dell'acido acetico è la conversione catalitica del metanolo con monossido di carbonio sotto pressione (processo Monsanto).
CH3OH + CO → CH3COOH
Oltre a questo, l'acido acetico può anche essere sintetizzato mediante ossidazione dell'acetaldeide con aria o ossigeno utilizzando Mn(OAc)2 come catalizzatore o per ossidazione parziale di altri idrocarburi.
Tecnicamente vengono utilizzate anche l'ossidazione ad aria dell'n-butano a circa 180 °C e 85 bar e l'ossidazione catalitica della benzina leggera.
Proprietà
Proprietà fisiche
Quando l'acido acetico viene sciolto in acqua, circa ogni centesima molecola di acido acetico si dissocia per formare uno ione acetato. Il protone scisso viene trasferito a una molecola d'acqua. Gli ioni ossonio formati in questo processo causano le proprietà acide delle soluzioni di acido acetico.
A 118 °C, l'acido acetico ha un punto di ebollizione relativamente alto rispetto alle sostanze polari con una massa molare comparabile (es. 1-propanolo:punto di ebollizione 97 °C). La ragione di ciò è la capacità delle molecole di acido acetico di formare due legami idrogeno "reciproci" tramite i loro gruppi carbossilici, in modo che i dimeri siano formati da due molecole di acido acetico, che si comportano come una molecola con il doppio della massa molare. Pertanto, è necessaria una maggiore quantità di energia per il trasferimento di questi dimeri nella fase gassosa, riconoscibile dalla temperatura di ebollizione "aumentata".
Proprietà chimiche
L'acido acetico si ossida completamente nell'aria formando acqua e anidride carbonica.
Metalli di base come magnesio, calcio, zinco o ferro si sciolgono in acido acetico diluito per formare acetati idrosolubili e rilasciare idrogeno.
L'acido acetico reagisce con il rame in presenza di ossigeno (aria) per formare acetato di rame, un sale nocivo verde meglio noto come verderame.
L'acido acetico reagisce con l'etanolo per formare acetato di etile, un solvente ampiamente utilizzato. Sostituendo 1-pentanolo con etanolo si ottiene acetato di amile, che è un estere dall'odore forte. L'acido salicilico può anche essere esterificato con acido acetico. Questo produce acido acetilsalicilico, il principio attivo dell'aspirina.
L'acido acetico reagisce a 800 °C con disidratazione ad anidride acetica.
L'acido acetico diluito viene utilizzato anche per sciogliere il calcare (vedi aceto). L'equazione di reazione è simile alla seguente:
Proprietà termodinamiche
L'entropia standard del liquido a un bar (Sl, 1 bar ) è 158,0 J mol K, quello del solido (Ss ) 282,84 J mol K.
Utilizzo
L'acido acetico è di grande importanza come agente aromatizzante. L'acido acetico e i suoi sali acetato di potassio (E 261), acetato di sodio (E 262) e acetato di calcio (E 263) sono usati come acidificanti per frutta e verdura in lattine e vasetti (0,5–3% di acido acetico), per tutti i tipi di pesce, conserve, marinate varie, insalate di salumeria, maionese, condimenti per insalate insieme ad acido sorbico (E 200) o acido benzoico (E 210) e per marinare e lavare la carne fresca.
L'effetto battericida dell'acido acetico è che il valore del pH modificato impedisce i processi fisiologici e denatura anche le proteine.
L'acido acetico è utilizzato anche nella produzione di cosmetici (creme, saponi).
Sali di acido acetico (acetati)
I sali o esteri dell'acido acetico sono chiamati acetati designato. Sono per lo più sali cristallini incolori che contengono l'anione acetato (CH3 COO).
Esempi di acetati simili al sale sono l'acetato di sodio (NaCH3 COO), acetato di potassio (KCH3 COO) o acetato di piombo(II) (Pb(CH3 COO)2 ).
Gli acetati salini si ottengono neutralizzando l'acido acetico con idrossidi metallici o ossidi metallici:
-
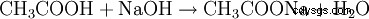
- L'acido acetico e l'idrossido di sodio reagiscono per formare acetato di sodio e acqua.
-
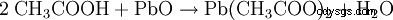
- L'acido acetico e l'ossido di piombo(II) producono acetato di piombo e acqua.
Nell'analisi chimica, gli acetati possono essere facilmente rilevati macinando il campione con solfato di idrogeno di potassio in un mortaio. In questo processo, il protone (H) dello ione idrogeno solfatato viene trasferito allo ione acetato, producendo acido acetico volatile, facilmente identificabile per il suo odore caratteristico:
-

- L'acetato è protonato dall'idrogeno solforato. Si formano acido acetico e solfato.
Gli esteri dell'acido acetico contengono il radicale acetilico come radicale acido. Il più noto di questi esteri è l'acetato di etile. Gli acetati organici si ottengono esterificando l'acido acetico con alcoli (R-OH):
-

- L'acido acetico e l'alcol reagiscono per formare un estere di acido acetico e acqua.
Fonti
- ↑ Database delle sostanze BGIA GESTIS:https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 agosto 2007