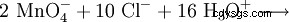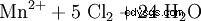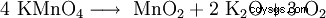| formule structurelle | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Général | |||||||||
| Nom | Permanganate de potassium | ||||||||
| Autres noms | |||||||||
| Formule moléculaire | KMnO4 | ||||||||
| Numéro CAS | 7722-64-7 | ||||||||
| Brève description | cristaux violet foncé avec éclat métallique | ||||||||
| Propriétés | |||||||||
| Masse molaire | 158,03 g mol | ||||||||
| État de la matière | corrigé | ||||||||
| Densité | 2.70g cm | ||||||||
| Point de fusion | Décomposition au-dessus de 240 °C | ||||||||
| Point d'ébullition | Non applicable | ||||||||
| Pression de vapeur | |||||||||
| Solubilité | |||||||||
| Consignes de sécurité | |||||||||
| |||||||||
| MAK | |||||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||||
Permanganate de potassium (KMnO4 ) est le sel de potassium de l'acide permanganique, HMnO4, qui est inconnu à l'état libre . C'est un solide cristallin d'éclat métallique rouge-violet profond et un oxydant puissant. L'anion permanganate est le seul responsable de la couleur intense du sel. Elle est due à la formation d'un complexe de transfert de charge. Dans les permanganates, le manganèse est dans son état d'oxydation le plus élevé, VII.
Propriétés
Le permanganate de potassium forme des cristaux brillants rouge-violet foncé qui sont modérément solubles dans l'eau et produisent une solution intensément violette même à de faibles concentrations. Lorsqu'ils sont chauffés, les cristaux ne fondent pas, mais se désintègrent avec un crépitement perceptible, libérant de l'oxygène. Le permanganate de potassium cristallin est stable à température ambiante, mais ses solutions aqueuses se dégradent avec le temps.
Étant donné que le manganèse est présent dans son état d'oxydation le plus élevé dans l'anion permanganate, il se présente comme un agent oxydant très puissant dans les réactions redox. Par exemple, le permanganate de potassium oxyde l'acide chlorhydrique en chlore gazeux (méthode de laboratoire pour la préparation du chlore) :
De plus, il oxyde, par exemple, les sulfites en sulfates, les ions Fe(II) en Fe(III), les alcools en acides carboxyliques. Il peut également provoquer la décomposition de substances [[chimie organique|organiques]. Le permanganate de potassium est oxydant.
Le permanganate de potassium se décompose à partir de 240 °C en dioxyde de manganèse (MnO2 ), oxyde de potassium (K2 O) et oxygène (O2 ):
En tant que complexe avec les éthers couronnes, le permanganate de potassium peut également être mis à disposition dans des solvants organiques non polaires tels que le benzène ou le toluène, qui est exploité en chimie organique de synthèse.
Fabrication
La production technique part du dioxyde de manganèse MnO2 avec de l'hydroxyde de potassium et de l'oxygène atmosphérique pour former le manganate de potassium (VI) K2 de couleur verte MnO4 réagi. Celui-ci est ensuite traité électrochimiquement pour former du permanganate de potassium (oxydation anodique) et est vendu sous forme cristalline.
Utilisation
En raison de son fort effet oxydant, le permanganate de potassium est utilisé, entre autres, comme désinfectant, déodorant et algicide. En analyse chimique quantitative ( oxydimétrie , manganométrie , titrage redox ), il est utilisé pour déterminer un grand nombre de substances (par exemple le fer , le nitrite , l' oxalate et indirectement aussi le calcium ); ici, le point final de la détermination est indiqué par la couleur violette. En laboratoire, une solution alcaline de permanganate de potassium est également utilisée pour nettoyer la verrerie. En photographie, il est utilisé pour détecter le sel fixateur (thiosulfate de sodium) et pour réduire les images surexposées; cela oxyde l'argent.
Lorsque de la glycérine est versée sur un excès de sel, le mélange s'enflamme après quelques secondes à quelques minutes et brûle avec une flamme violette caractéristique. Cette réaction retardée a été utilisée pour démarrer des réactions aluminothermiques en raison de la chaleur intense.
Médecine
En médecine, la solution de permanganate de potassium est utilisée comme astringent et désinfectant pour le traitement externe de la peau, par ex. pour le pied d'athlète ou l'érythème fessier (code ATC D08AX06). En toxicologie d'urgence, bourgogne La solution de permanganate de potassium (environ 0,1 %) est utilisée pour le lavage gastrique en cas d'intoxication après ingestion de toxines oxydables.
Historique
Les photographes du passé utilisaient le permanganate de potassium comme composant des poudres flash. Le permanganate de potassium était utilisé pour gargariser un mal de gorge et en cuisine pour désodoriser la viande rassise et la rendre à nouveau comestible.
Consignes de sécurité
Le permanganate de potassium appartient à la classe de danger pour l'eau 3 (très nocif pour l'eau), qui, en plus de son effet oxydant, doit être prise en compte lors de l'élimination des résidus de permanganate. Le permanganate de potassium a une faible toxicité aiguë (LD50 (rat, oral) =750 mg/kg), mais a un effet irritant prononcé sur les tissus vivants en raison de son fort effet oxydant, de sorte que des brûlures chimiques se produisent facilement. Tout contact autre qu'un usage médical voire une prise orale doit donc être proscrit ! La poussière de permanganate provoque une opacification de la cornée.
La décoloration de la peau elle-même, qui se produit au contact, est cependant inoffensive et est causée par le dioxyde de manganèse formé lors de la réduction du permanganate. Les zones décolorées plus importantes peuvent être décolorées à nouveau avec des solutions de sulfite.
En raison de son fort effet oxydant, le permanganate de potassium réagit violemment avec de nombreuses substances réductrices ou combustibles, et une auto-inflammation peut se produire. Les mélanges avec de telles substances qui ne conduisent pas à une réaction spontanée sont extrêmement inflammables et peuvent alors réagir de manière explosive.
Origine
- ↑ Entrée pour CAS no. 6487-48-5 dans la base de données des substances GESTIS du BGIA, récupéré le 15 décembre 2007 (JavaScript requis)
- ↑ Roth, Daunderer, Kormann :Plantes toxiques - toxines végétales, ecomed Landsberg, 1988, ISBN 3-609-64810-4 , p.810ff