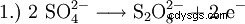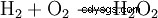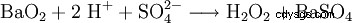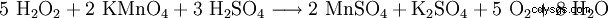| formule structurelle | ||||||||
|---|---|---|---|---|---|---|---|---|
| Général | ||||||||
| Nom | Peroxyde d'hydrogène | |||||||
| Autres noms | ||||||||
| Formule moléculaire | H2 O2 | |||||||
| Numéro CAS | 7722-84-1 (solution aqueuse) | |||||||
| Brève description | liquide incolore | |||||||
| Propriétés | ||||||||
| Masse molaire | 34,02 g mol | |||||||
| État de la matière | liquide | |||||||
| Densité | 1,45 g cm (20 °C, pur) 1,11 g cm (20 °C, 30 %) | |||||||
| Point de fusion | −0,41 °C (pur) −33 °C (35 %) −11 °C (90 %) | |||||||
| Point d'ébullition | 150,2 °C (pur) 108 °C (35 %) 142 °C (90 %, avec décomposition) | |||||||
| Pression de vapeur | ||||||||
| Solubilité | ||||||||
| Consignes de sécurité | ||||||||
| ||||||||
| MAK | ||||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | ||||||||
Peroxyde d'hydrogène (H2 O2 ) est un composé liquide bleu pâle, largement stable, d'hydrogène et d'oxygène, incolore sous forme diluée. Il est légèrement plus visqueux que l'eau, un acide faible et un agent oxydant très puissant pour la plupart des substances, qui en tant que tel réagit violemment avec des substances telles que par ex. B. le cuivre, le laiton, l'iodure de potassium réagissent et agissent ainsi comme un puissant agent de blanchiment et désinfectant. Sous une forme hautement concentrée, il peut être utilisé à la fois comme propulseur de fusée simple et comme composant.
Propriétés physiques
Le H2 O2 -La molécule est courbée (angle dièdre =111°). Le peroxyde d'hydrogène pur est très visqueux en raison de la forte réticulation par les liaisons hydrogène. Puisque hautement concentré (=presque anhydre) H2 O2 instable et se décompose spontanément en explosion, notamment lorsqu'il entre en contact avec des métaux, il est normalement vendu sans ordonnance sous forme d'une solution à 35 % maximum dans l'eau. Pour les besoins industriels, cependant, il existe également des concentrations de 50 % H2 O2 dans l'eau.
Le contact avec une solution de peroxyde d'hydrogène à plus de 20 % peut provoquer des brûlures chimiques. Des gants de protection doivent donc être portés lors de la manipulation.
Fabrication
Dans le passé, le peroxyde d'hydrogène était principalement produit par l'électrolyse de l'acide sulfurique. Cela forme de l'acide peroxodisulfurique, qui est ensuite hydrolysé en acide sulfurique et en peroxyde d'hydrogène.
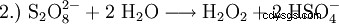
Aujourd'hui, le peroxyde d'hydrogène est produit techniquement selon le procédé à l'anthraquinone. A cet effet, l'anthrahydroquinone est mise à réagir avec l'oxygène atmosphérique sous pression pour former du peroxyde d'hydrogène et de l'anthraquinone. Dans l'étape suivante, l'anthraquinone peut être à nouveau réduite avec de l'hydrogène en anthrahydroquinone, etc. L'équation brute est :
À l'échelle du laboratoire, le peroxyde d'hydrogène est également produit lors du traitement des peroxydes avec des acides. Un réactif historiquement important est le peroxyde de baryum, qui réagit dans une solution d'acide sulfurique pour former du peroxyde d'hydrogène et du sulfate de baryum.
Les enthalpies molaires de formation sont :
- Δf Hgaz :−136,11 kJ/mol
- Δf Hliquide :−188 kJ/mol
- Δf Hsol :−200 kJ/mol
Propriétés chimiques
Le peroxyde d'hydrogène a tendance à se décomposer en eau et en oxygène. Cela libère une énergie de 98,02 kJ/mol :
-
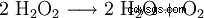
- Dismutation de deux molécules de peroxyde d'hydrogène dans l'eau et l'oxygène.
Cette réaction de décomposition est catalysée, entre autres, par Mn (voir preuve) ou d'autres ions de métaux lourds, I et OH. Donc H2 O2 - Les solutions disponibles dans le commerce sont mélangées avec des stabilisants (dont l'acide phosphorique). C'est un oxydant puissant. Lorsque l'état d'oxydation est réduit de -I à -II, seuls de l'eau et de l'oxygène se forment comme produits de réaction. Il n'y a pas de sous-produits difficiles à séparer ou perturbateurs, ce qui simplifie son utilisation en laboratoire.
Il peut également agir comme agent réducteur contre les agents oxydants plus puissants (par exemple, le permanganate de potassium).
Le peroxyde d'hydrogène est un acide très faible; ses sels inorganiques et ses esters organiques sont les hydroperoxydes et les peroxydes.
Preuve
Pour la détection qualitative, les ions Mn (par exemple MnSO4 ) admis. Si du gaz se développe, le test de la puce incandescente est utilisé pour vérifier la présence d'oxygène. Si cela s'avère positif, dans la mesure où la puce incandescente brille, H2 était O2 présent.
- Détection en tant que peroxyde de chrome (CrO(O2 )2 )
Faire de la répétition du festival. Trioxyde de chrome CrO3 avec du peroxyde d'hydrogène dans la gamme fortement acide (pH <0) donne le peroxyde de chrome de couleur bleu intense, qui se dissout dans l'éther. Pour ce faire, bichromate de potassium avec H2 dilué SO4 acidifier et couvrir avec 1 cm d'éther (déduction !), ajouter l'échantillon et agiter. La phase éthérée devient bleutée.
- Détection en tant qu'ion peroxotitanyl(IV) ([Ti(O2 )OH])
La détection avec le "jaune de titane" (à ne pas confondre avec un colorant du même nom) est très sensible. Les ions titane (IV) (incolores), même avec des traces de peroxyde d'hydrogène, donnent l'ion peroxotitanyle intensément coloré en jaune orangé. Inversement, une substance peut donc également être testée pour le titane(IV) avec du peroxyde d'hydrogène.
- Détection au permanganate de potassium
Pour déterminer la concentration dans des solutions aqueuses, par ex. B. bains de blanchiment Le dosage est effectué par oxymétrie avec une solution de permanganate de potassium n/10 dans une solution d'acide sulfurique (passage à la coloration rose pâle permanente (durée environ 1 min) selon l'équation suivante :
Physiologie
Le peroxyde d'hydrogène est très corrosif, surtout sous forme de vapeur. Si vous recevez du peroxyde d'hydrogène sur votre peau, vous devez bien rincer la zone avec de l'eau (dilution), ou au moins l'enlever immédiatement de votre peau. Il tue rapidement les cellules de la peau, qui deviennent alors blanches.
En général, le peroxyde d'hydrogène a un effet cytotoxique et, en raison de sa forte toxicité pour de nombreux micro-organismes procaryotes, a un effet désinfectant.
Le peroxyde d'hydrogène se forme dans de nombreux processus biochimiques. Dans le cycle biologique, il se forme par le métabolisme oxydatif du sucre. L'organisme se protège contre ses effets toxiques à l'aide d'enzymes - catalases, peroxydases - qui le reconvertissent en O2 non toxique et H2 Décomposer O.
Après la fécondation par un spermatozoïde, l'ovule femelle produit brièvement de faibles concentrations de peroxyde d'hydrogène pour tuer les autres spermatozoïdes.
De plus, le peroxyde d'hydrogène est une molécule signal pour induire la défense de la plante contre les pathogènes (aspect cytotoxicité).
Utilisation
Javel
Le peroxyde d'hydrogène est un agent de blanchiment, il est donc utilisé dans les cosmétiques pour blanchir les cheveux et blanchir les dents. Il est souvent utilisé comme peroxyde lié au carbamide.
- Le blond platine, le maximum d'évitement de la couleur dans les cheveux, que l'humanité doit au peroxyde d'hydrogène. Le liquide extrêmement réactif détruit les pigments de couleur dans les cheveux.
Dans le monde entier, la plus grande application peut être vue dans le blanchiment écologique de la pâte à papier. La pâte est obtenue à partir du bois et de la lignine qu'elle contient avec H2 O2 blanchi. La pulpe est principalement utilisée dans la fabrication de papier, serviettes, mouchoirs, etc.
Dans l'artisanat, le peroxyde d'hydrogène est utilisé pour blanchir - c'est-à-dire pour éclaircir - le bois, par ex. B. pendant la restauration ou la rénovation.
Le peroxyde d'hydrogène ou les agents de blanchiment contenant du peroxyde d'hydrogène, comme un mélange d'acide peroxyacétique et de peroxyde d'hydrogène, sont également utilisés dans la publicité avec le mot artificiel oxygène actif appelé.
Désinfection et stérilisation
Pour la désinfection, le peroxyde d'hydrogène est utilisé sous forme de solution à trois pour cent dans la bouche et la gorge, par ex. B. en dentisterie; il est également utilisé pour désinfecter les lentilles de contact dans les nettoyants pour lentilles de contact et pour stériliser les matériaux d'emballage, ainsi que pour désinfecter les mains. Il est également utilisé dans les crèmes pour la peau du visage pour ouvrir les pores et combattre les boutons et les imperfections. Il est souvent utilisé pour nettoyer les eaux usées industrielles et pour désinfecter l'eau des piscines.
Dans l'industrie alimentaire, le peroxyde d'hydrogène à 30 % est utilisé dans les systèmes de remplissage aseptique pour stériliser les bouteilles en PET. De nombreux aliments (boissons, lait, produits laitiers, sauces, soupes, etc.) sont emballés de manière aseptique dans des cartons, des gobelets, des bouteilles et des feuilles pour améliorer durée de conservation et qualité du produit. Le procédé le plus couramment utilisé est basé sur la stérilisation au peroxyde d'hydrogène concentré (35%). L'effet bactéricide élevé de H2 O2 , la compatibilité environnementale et la bonne faisabilité technique sont les raisons de la généralisation de ce procédé. Dans la pratique opérationnelle, une distinction est faite entre le procédé par pulvérisation et le procédé par bain d'immersion.
Distribution d'oxygène
Le peroxyde d'hydrogène peut être utilisé dans les aquariums pour fournir de l'oxygène. L'oxygène est généré dans un oxydant. Pour ce faire, le peroxyde d'hydrogène est divisé en radicaux d'eau et d'oxygène dans un récipient de l'aquarium à l'aide d'un catalyseur.
Utilisation de plusieurs effets en même temps
Lors de la rénovation d'intérieurs, le peroxyde d'hydrogène peut être utilisé pour lutter contre la croissance des moisissures. En tant que désinfectant, il peut à la fois tuer les cellules biologiquement actives (fongicide) et détruire les spores (sporicide). Il ne peut pas non plus être utilisé comme agent de blanchiment Enlèvement des résidus du revêtement - sur une surface poreuse blanche - "optiquement inoffensif". Le peroxyde d'hydrogène est préférable à l'alcool ou à l'hypochlorite de sodium car ces substances sont des sous-produits tels que B. les sels du sous-sol peuvent produire. L'alcool n'est ni sporicide ni blanchissant par rapport au peroxyde d'hydrogène.
Le peroxyde d'hydrogène est également utilisé pour le blanchiment et la désinfection dans la préparation des os. En dentisterie, H2 O2 utilisé pour la désinfection locale du tissu dentaire et pour arrêter le saignement lors d'interventions mineures.
En agriculture, le peroxyde d'hydrogène est utilisé pour désinfecter les serres et pour oxygéner les milieux de culture hydroponiques.
Biologie
Pour déterminer les cultures bactériennes, le test de catalase est effectué avec une solution de peroxyde d'hydrogène à 3 %. La plupart des bactéries aérobies et anaérobies facultatives, ainsi que des champignons, possèdent l'enzyme catalase, qui est capable de décomposer H2, qui est toxique pour les cellules O2 diviser.
Le peroxyde d'hydrogène peut être utilisé en médecine légale pour détecter le sang. En 1818, Louis Jacques Thenard découvre que la peroxydase de l'hémoglobine décompose le peroxyde d'hydrogène. Christian Friedrich Schönbein a développé un test sanguin à partir de cela en 1863. Aujourd'hui, cependant, le test de Kastle-Meyer, plus sensible, est utilisé pour détecter le sang.
Expérimentalement, le peroxyde d'hydrogène est utilisé en biologie pour induire la mort cellulaire programmée dans des cellules eucaryotes isolées.
Caustiques
En microélectronique, le mélange d'acide sulfurique et de peroxyde d'hydrogène - appelé "piranha" - est utilisé pour nettoyer la surface des plaquettes et pour produire une fine couche d'oxyde hydrophile d'environ 3 à 4 nm d'épaisseur sur les plaquettes. De nos jours, le terme "SPM" (mélange de peroxyde sulfurique) est plus courant. L'application principale est l'élimination des résines photosensibles.
Dans la fabrication de cartes de circuits imprimés (PCB), des bains de gravure au chlorure de cuivre sont utilisés pour éliminer le cuivre :
-
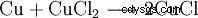 .
. - Le cuivre élémentaire réagit avec le chlorure de cuivre(II) pour former du chlorure de cuivre(I). C'est une proportion.
Le peroxyde d'hydrogène est utilisé avec l'acide chlorhydrique pour régénérer les bains de gravure au chlorure de cuivre :
-
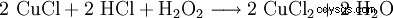 .
. - Le chlorure de cuivre(II) est régénéré en faisant réagir le chlorure de cuivre(I) avec du peroxyde d'hydrogène et de l'acide chlorhydrique. L'atome de cuivre est oxydé.
L'ajout de peroxyde d'hydrogène et d'acide chlorhydrique est contrôlé via le potentiel redox.
Moteurs de fusée/torpille
En tant que fournisseur d'énergie et d'oxygène (décomposition via le dioxyde de manganèse par exemple), il était utilisé sous forme concentrée dans les propulsions de fusées (ex :Max Valier, Messerschmitt Me 163) et les propulsions de sous-marins (Walter U-Boot). Le peroxyde d'hydrogène, décomposé à l'aide de permanganate de potassium, était également utilisé comme propulseur pour les pompes à carburant (500 ch) de l'A4. Le peroxyde d'hydrogène non décomposé était utilisé comme transporteur d'oxygène, liquide à température normale, dans les fusées britanniques (par exemple Black Arrow) et y était brûlé avec du kérosène.
Le peroxyde d'hydrogène a tendance à se décomposer de manière incontrôlée. Ainsi mourut le 16 juillet 1934 le Dr. Kurt Wahmke et deux techniciens à Kummersdorf lors de l'explosion d'un moteur alimenté au peroxyde d'hydrogène. En raison de la dangerosité de l'utilisation et de la manipulation (effet corrosif, décomposition incontrôlée, explosion si le réservoir et la tuyauterie sont contaminés), l'utilisation est désormais limitée aux petits moteurs fusées (tentatives de record, moteurs de contrôle).
Le naufrage du sous-marin nucléaire russe Koursk en 2000, la rumeur disait que du peroxyde d'hydrogène s'échappait d'un réservoir d'une torpille et réagissait ensuite avec des pièces en cuivre, provoquant la rupture de la torpille.
Fabrication d'explosifs
En présence d'un catalyseur approprié, le peroxyde d'hydrogène réagit avec l'acétone pour former du peroxyde d'acétone. Le peroxyde d'acétone est un explosif mais n'est pas utilisé commercialement car il est très dangereux à manipuler. Plus précisément, le peroxyde d'acétone est également appelé triperoxyde de triacétone, en abrégé TATP. D'autres explosifs fabriqués avec du peroxyde d'hydrogène comprennent l'hexaméthylène triperoxyde diamine (HMTD).
Selon les experts de l'Institut Fraunhofer de technologie chimique, le TATP est utilisé dans la plupart des attentats-suicides en Israël. Les attentats du 7 juillet 2005 dans le métro londonien (55 morts) auraient également été perpétrés avec le TATP. Enfin, le 4 septembre 2007, trois islamistes formés au Pakistan ont été arrêtés à Oberschledorn, dans le Sauerland, qui voulaient produire du TATP à partir de 730 kilogrammes d'une solution de peroxyde d'hydrogène à 35 % afin d'attaquer des installations américaines et des restaurants en Allemagne fréquentés par des citoyens américains.
D'autre part, les experts ne savent pas en détail comment les terroristes pourraient faire exploser du TATP à base de peroxyde d'hydrogène de manière contrôlée. En particulier, lors d'une tentative déjouée de contrebande d'explosifs liquides dans un avion à Londres en 2007, on s'est demandé si du peroxyde d'acétone approprié pouvait être produit à bord en utilisant des bouteilles de contrebande de peroxyde d'hydrogène et d'acétone.
Références
- Werner R. Thiel :Nouvelles voies vers le peroxyde d'hydrogène :alternatives aux procédés établis ? Angewandte Chemie 111(21), pages 3349-3351 (1999)
- Heribert Offermanns, Gunther Dittrich, Norbert Steiner :Le peroxyde d'hydrogène dans la protection de l'environnement et la synthèse . La chimie à notre époque 34(3), pp. 150–159 (2000), ISSN 0009-2851
Références
- ↑ Entrée sur le peroxyde d'hydrogène dans la base de données des substances GESTIS du BGIA, récupérée le 16/11/2007 (JavaScript requis)
- ↑ Süddeutsche Zeitung du 6 septembre 2007, p. 2 :"Encyclopédie actuelle :peroxyde d'hydrogène “. Signé :mkf
- ↑ Les informations contenues dans ce paragraphe sont basées sur celles de mkf article signé "Encyclopédie actuelle :Peroxyde d'hydrogène " à la page 2 du Süddeutsche Zeitung du 6.9.2007.
- ↑ Süddeutsche Zeitung du 6 septembre 2007, p. 1f.
- ↑ netzeitung.de
- ↑ Rundschau-online.de
- ↑ Ce paragraphe fait référence à oraclesyndicate - Karl Weiss et à l'article Wikipedia Peroxyde d'acétone.