| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| 2 Na | |||||||
| Général | |||||||
| Nom | Sulfate de sodium | ||||||
| Autres noms | |||||||
| Formule moléculaire | Na2 SO4 | ||||||
| Numéro CAS | 7757-82-6 | ||||||
| Brève description | cristaux incolores et inodores | ||||||
| Propriétés | |||||||
| Masse molaire | 142,04 g mol | ||||||
| État de la matière | corrigé | ||||||
| Densité | 2.70g cm | ||||||
| Point de fusion | 884 °C | ||||||
| Point d'ébullition | 1689 °C | ||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
Sulfate de sodium (Na2 SO4 , nom obsolète Sulfate de sodium ) est un sel de sodium de l'acide sulfurique et se compose de deux cations Na (Na) et de l'anion sulfate (SO4 ) ensemble. Le décahydrate (Na2 SO4 · 10H2 O) est aussi appelé Glaubersalz d'après le chimiste Johann Rudolph Glauber Aussi appelé Sel de Carlsbad , qui est obtenu par évaporation de l'eau minérale de Karlovy Vary, se compose principalement de sulfate de sodium décahydraté et est utilisé comme laxatif, comme le sel de Glauber.
Historique
Le sulfate de sodium a été produit et décrit vers 1655 par le chimiste et pharmacien Johann Rudolph Glauber. Il a lui-même appelé le sel qu'il a découvert Sal mirabilis et Mirabili .
Obtenir et afficher
Le sulfate de sodium est rarement extrait de minéraux naturels, car il s'agit souvent d'un sous-produit de réactions de l'industrie chimique dans lesquelles l'acide sulfurique est neutralisé avec de la soude caustique. Une autre possibilité de représentation technique est la réaction du sel gemme (NaCl) avec l'acide sulfurique afin d'obtenir de l'acide chlorhydrique avec du sulfate de sodium comme sous-produit (à 800 °C) :
-
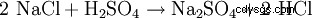
- Le chlorure de sodium et l'acide sulfurique réagissent pour former du sulfate de sodium et du chlorure d'hydrogène.
Le sulfate de sodium peut être produit en laboratoire par les réactions suivantes :
-

- Le sodium et l'acide sulfurique réagissent pour former du sulfate de sodium et de l'hydrogène.
-
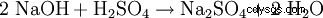
- Du sulfate de sodium et de l'eau sont produits lors de la neutralisation de la soude caustique avec de l'acide sulfurique.
Propriétés
Le sulfate de sodium anhydre fond à 884 °C, est hygroscopique et facilement soluble dans l'eau lorsqu'il est chauffé (chaleur de la solution). En revanche, le décahydrate se dissout sous un fort refroidissement, en raison de l'effet dit d'entropie. Le sulfate de sodium décahydraté est un composant de nombreuses eaux minérales et fond lentement dans sa propre eau cristalline à partir d'environ 32 °C. Le sel anhydre se sépare de cette solution qui est sursaturée en sulfate de sodium anhydre.
Utilisation
Le sulfate de sodium est utilisé dans les détergents comme charge, en médecine comme laxatif, dans la production de pâte à papier (procédé au sulfate) et dans les industries du verre, du textile et de la peinture. Le sulfate de sodium anhydre recuit est utilisé en laboratoire pour sécher les solvants organiques. Sulfate de sodium décahydraté (sel de Glauber ) est utilisé comme laxatif et matériau de stockage de chaleur latente.
Dans la technologie alimentaire, il est utilisé comme agent raffermissant, régulateur d'acidité et substance porteuse. Le sulfate de sodium et l'hydrogénosulfate de sodium sont des additifs alimentaires numérotés E 514 dans l'UE. sans limite maximale (quantum satis ) généralement approuvé pour l'alimentation.
Origine
- ↑ https://www.zusatzstoffe-online.de/zusatzstoffe/216.e514_natriumsulfate.html
