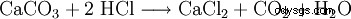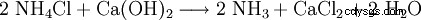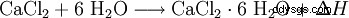| formule structurelle | |||||||
|---|---|---|---|---|---|---|---|
| Aucune formule structurelle disponible | |||||||
| Général | |||||||
| Nom | Chlorure de calcium | ||||||
| Autres noms |
| ||||||
| Formule moléculaire | CaCl2 | ||||||
| Numéro CAS | 10043-52-4 (anhydre) 10035-04-8 (dihydraté) 25094-02-4 (tétrahydraté) 07774-34-7 (hexahydraté) | ||||||
| Brève description | cristaux hygroscopiques incolores et inodores | ||||||
| Propriétés | |||||||
| Masse molaire | 110,98 g mol (anhydre) 147,02 g mol (dihydraté) 182,04 g mol (tétrahydraté) 219,08 g mol (hexahydraté) | ||||||
| État de la matière | corrigé | ||||||
| Densité | 2,16 g cm (anhydre) 1,85 g cm (dihydraté) 1,71 g cm (hexahydraté) | ||||||
| Point de fusion | 782 °C (anhydre) env. 176 °C (dihydraté) env. 35 °C (tétrahydrate) | ||||||
| Point d'ébullition | 1935 °C | ||||||
| Pression de vapeur | |||||||
| Solubilité | |||||||
| Consignes de sécurité | |||||||
| |||||||
| Lorsque cela est possible et courant, les unités SI sont utilisées. Sauf mention contraire, les données indiquées s'appliquent dans des conditions standard. | |||||||
| Structure cristalline ||Rutile (déformé), octaédriquechlorure de calcium (aussi chlorure de calcium ) est un chlorure du calcium de métal alcalino-terreux avec la formule moléculaire CaCl2 . Le calcium a l'état d'oxydation +2, le chlore a l'état d'oxydation -1.
Historique
Vers 1860, les chimistes Robert Wilhelm Bunsen et Matthiessen réussissent la première préparation pure de l'élément calcium par électrolyse du chlorure de calcium.
Occurrences
Le chlorure de calcium est présent dans la nature dissous dans des saumures salées.
Obtenir et afficher
Le chlorure de calcium est fabriqué à partir d'acide chlorhydrique et de carbonate de calcium :
Un chauffage ultérieur à 260 °C fournit la forme anhydre.
Techniquement, le chlorure de calcium est obtenu en tant que déchet de la production de soude avec le procédé Solvay, à savoir lorsque l'ammoniac est récupéré à partir du chlorure d'ammonium produit :
Propriétés
Le chlorure de calcium est un sel. Le calcium et le chlore existent sous forme d'ions en raison de la grande différence d'électronégativité. La liaison se fait donc via des interactions électrostatiques.
Sous sa forme pure, le chlorure de calcium forme des cristaux incolores et est fortement hygroscopique lorsqu'il est anhydre. Il absorbe facilement l'eau de son environnement, formant un complexe d'hydrates.
Réactions
Le chlorure de calcium réagit avec l'eau pour former un complexe hexahydraté et développe beaucoup de chaleur (exothermique, ΔH> 0) :
Les cristaux de l'hexahydrate se dissolvent dans leur propre eau de cristallisation à environ 30 °C. L'eau liée est à nouveau libérée par chauffage à environ 200 °C. La dissolution dans l'eau, contrairement au chlorure de calcium anhydre, conduit à un fort refroidissement. Les deux formes de chlorure de calcium sont également facilement solubles dans l'éthanol.
Utilisation
En raison de son hygrométrie, le chlorure de calcium anhydre est un agent de séchage important en laboratoire, par exemple dans le dessiccateur, et en chimie technique pour une grande variété de gaz et de liquides. Les domaines d'application sont l'assèchement des espaces de vie, l'utilisation comme antigel, notamment comme antigel et accélérateur de prise dans le béton, et comme abat-poussière (par exemple sur les chantiers). En médecine, il est utilisé pour arrêter les saignements et pour traiter les maladies de carence en calcium, ainsi que pour traiter les engelures et les allergies.
Il est utilisé comme agent raffermissant, exhausteur de goût et stabilisant (par exemple dans le traitement de l'eau potable, le traitement de surface des fruits). Dans l'UE, il porte le numéro E 509 en tant qu'additif alimentaire. approuvé.
Le chlorure de calcium est utilisé pour réchauffer les boissons prêtes à boire en utilisant une hydratation exothermique lors de la réaction avec l'eau. Il est également utilisé comme sel de voirie et pour la production de mélanges rafraîchissants (voir ci-dessus ).
Il est également utilisé pour coaguler les protéines dans la technologie alimentaire et est utilisé dans la fabrication de produits tels que le tofu ou le caviar artificiel.
Origine
- ↑ Base de données des substances BGIA GESTIS :https://www.hvbg.de/d/bia/gestis/stoffdb/index.html . 9 mai. 2007