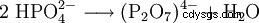Diphosphates (aussi pyrophosphates (PPa; Anglais :PPi )) sont des sels et des esters de l'acide diphosphorique H4 P2 O7 . Les diphosphates sont des condensats de deux phosphates. Ils sont liés par une liaison anhydride d'acide P-O-P (formule constitutionnelle ((O3 P)-O-(PO3 )). Les esters de ces composés ont également une liaison C-O-P et ont la formule constitutionnelle générale R-O-((PO2 )-O-(PO3 )) (R :résidu organique).
Exemples
|
| |||||||||||||||||||||||||||||
Synthèse
Si vous recuisez des phosphates secondaires, le diphosphate se forme avec l'élimination de l'eau.
Importance biochimique
Les composés contenant du diphosphate jouent un rôle important dans les processus de transfert d'énergie dans les cellules vivantes (cf., par exemple, l'adénosine diphosphate, qui se produit lorsque l'adénosine triphosphate est consommée). Le clivage du diphosphate libère de l'énergie, puisque le diphosphate libre résultant est stabilisé par mésomérisme et hydratation d'une part. D'autre part, un effet entropique entre également en jeu, puisque l'entropie du système a augmenté. Cette énergie est souvent utilisée pour permettre une réaction couplée à ce processus, mais endothermique. Les diphosphates sont souvent divisés en deux phosphates par des pyrophosphatases afin de rendre la réaction respective irréversible. Il est également discuté si, en plus de l'ATP, les diphosphates peuvent également être utilisés comme sources d'énergie alternatives dans les bactéries et les plantes.
Chimie alimentaire
Les diphosphates sont répertoriés comme additif alimentaire sous le numéro E 450 approuvés et sont utilisés en chimie alimentaire comme émulsifiants, entre autres, mais ils ont un certain nombre d'autres propriétés et peuvent également agir comme conservateurs, antioxydants, agents de séparation et de levage. Cette classe d'émulsifiants produite artificiellement lie l'eau, empêche les aliments en poudre de s'agglutiner et, en combinaison avec le calcium, donne une consistance crémeuse. Étant donné que le phosphore est suspecté de déclencher l'hyperactivité, les réactions allergiques et l'ostéoporose, le dosage correct doit toujours être pris lors de la prise de phosphates.
Littérature
- ↑ Serrano A. et al. , H-PPases :hier, aujourd'hui et demain. La vie de l'IUBMB. 2007 février;59(2):76-83 PMID 17454298
- ↑ Baltscheffsky M., Pyrophosphate inorganique en tant que donneur d'énergie dans les systèmes de phosphorylation par transport d'électrons photosynthétiques et respiratoires. Biochem Biophys Res Commun. 21 juillet 1967;28(2):270-6 PMID 4291991